Эрдафитиниб - Erdafitinib
 | |
| Клинические данные | |
|---|---|
| Торговые наименования | Бальверса |
| Другие имена | JNJ-42756493 |
| AHFS /Drugs.com | Монография |
| MedlinePlus | a619031 |
| Данные лицензии |
|
| Беременность категория |
|
| Маршруты администрация | Устный |
| Класс препарата | Азоторганические соединения |
| Легальное положение | |
| Легальное положение |
|
| Идентификаторы | |
| |
| Количество CAS | |
| PubChem CID | |
| PubChem SID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| КЕГГ | |
| ЧЭМБЛ | |
| ECHA InfoCard | 100.235.008 |
| Химические и физические данные | |
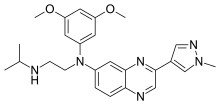
| Формула | C25ЧАС30N6О2 |
| Молярная масса | 446.555 г · моль−1 |
| 3D модель (JSmol ) | |
| |
| |
Эрдафитиниб представляет собой низкомолекулярный ингибитор рецептор фактора роста фибробластов (FGFR) одобрен для лечения рака и продается под названием Бальверса. FGFR являются подмножеством тирозинкиназы которые не регулируются в некоторых опухолях и влияют на опухоль дифференциация клеток, распространение, ангиогенез, и выживаемость клеток.[1][2] Astex Pharmaceuticals обнаруженный препарат и лицензию на него Janssen Pharmaceuticals для дальнейшего разработка.[1]
Исследователи изучили безопасность и эффективность эрдафитиниба при лечении рак желчного протока, рак желудка, немелкоклеточный рак легкого, и рак пищевода.[3]
В марте 2018 г. был назначен эрдафитиниб. революционная терапия обозначение США Управление по контролю за продуктами и лекарствами (FDA) для лечения уротелиальный рак.[1]
В апреле 2019 года эрдафитиниб был одобрен FDA для лечения метастатических или местнораспространенных заболеваний. Рак мочевого пузыря с изменением FGFR3 или FGFR2, которое вышло за рамки традиционных методов лечения на основе платины, при условии подтверждающих испытаний.[2][4] Соединенные штаты. Управление по контролю за продуктами и лекарствами (FDA) считает, что это первое в своем классе лекарство.[5]
Дозировка
Эрдафитиниб - это таблетка, которую принимают один раз в день, общая доза составляет 8 мг. Во время лечения доза эрдафитиниба может быть увеличена до 9 мг при необходимости.[6]
Побочные эффекты
Общие побочные эффекты включают повышенный уровень фосфата, язвы во рту, чувство усталости, изменение функции почек, диарею, сухость во рту, отделение ногтей от ложа или плохое формирование ногтя, изменение функции печени, низкий уровень соли (натрия), снижение аппетита. , изменение вкусовых ощущений, низкий уровень эритроцитов (анемия), сухость кожи, сухость глаз и выпадение волос.[2] Другие побочные эффекты включают покраснение, отек, шелушение или болезненность на руках или ногах (синдром кистей и стоп), запор, боль в животе, тошноту и мышечную боль.[2]
Эрдафитиниб может вызвать серьезные проблемы со зрением, включая воспаление глаз, воспаление роговицы (передней части глаза) и нарушения сетчатки, внутренней части глаза.[2] Пациентам рекомендуется периодически проходить обследование глаз и сразу же сообщать своему лечащему врачу, если у них появилось нечеткое зрение, потеря зрения или другие визуальные изменения.[2]
История
Эффективность эрдафитиниба изучалась в клиническом исследовании (NCT02365597), в котором участвовали 87 взрослых с местнораспространенным или метастатическим раком мочевого пузыря с генетическими изменениями FGFR3 или FGFR2, которые прогрессировали после лечения химиотерапией.[2][6] Общий процент ответов у этих взрослых составил 32,2%, из которых 2,3% имели полный ответ и почти 30% имели частичный ответ.[2] Ответ длился в среднем примерно пять с половиной месяцев.[2] Испытание проводилось в Азии, Европе и США.[6]
Эрдафитиниб получил ускоренное одобрение.[2] Для подтверждения клинической пользы эрдафитиниба требуются дальнейшие клинические испытания, и спонсор проводит или планирует провести эти исследования.[2] Эрдафитиниб также был предоставлен революционная терапия обозначение.[2]
FDA одобрило производство Balversa компании Janssen Pharmaceutical.[2] FDA также одобрило набор Therascreen FGFR RGQ RT-PCR Kit, разработанный Qiagen Manchester, Ltd., для использования в качестве дополнительной диагностики с Balversa для этого терапевтического показания.[2]
Рекомендации
- ^ а б c «Janssen объявляет о присвоении Управлением США по санитарному надзору за качеством пищевых продуктов и медикаментов США передовым терапевтическим назначением Эрдафитиниба для лечения метастатического рака уротелия». Джонсон и Джонсон (Пресс-релиз). В архиве с оригинала от 20 июня 2018 г.
- ^ а б c d е ж грамм час я j k л м п «FDA одобряет первую таргетную терапию метастатического рака мочевого пузыря». НАС. Управление по контролю за продуктами и лекарствами (FDA) (Пресс-релиз). 12 апреля 2019. В архиве с оригинала 15 ноября 2019 г.. Получено 13 мая 2019.
 Эта статья включает текст из этого источника, который находится в всеобщее достояние.
Эта статья включает текст из этого источника, который находится в всеобщее достояние. - ^ Bahleda R, Italiano A, Hierro C, Mita A, Cervantes A, Chan N, Awad M, Calvo E, Moreno V, Govindan R, Spira A, Gonzalez M, Zhong B, Santiago-Walker A, Poggesi I, Parekh T., Се Х, Инфанте Дж, Табернеро Дж (август 2019 г.). «Многоцентровое исследование фазы I Эрдафитиниба (JNJ-42756493), орального ингибитора рецептора фактора роста пан-фибробластов, у пациентов с запущенными или рефрактерными солидными опухолями». Clin. Рак Res. 25 (16): 4888–97. Дои:10.1158 / 1078-0432.CCR-18-3334. PMID 31088831. S2CID 155089088.
- ^ «Balversa (эрдафитиниб) получает одобрение FDA США для лечения пациентов с местно-распространенной или метастатической уротелиальной карциномой с определенными генетическими изменениями FGFR». Джонсон и Джонсон (Пресс-релиз). 8 мая 2019. В архиве с оригинала 8 мая 2019 г.. Получено 24 ноября 2019.
- ^ «Новые разрешения на лекарственную терапию 2019». Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. 31 декабря 2019 г.. Получено 15 сентября 2020.
- ^ а б c "Снимки испытаний лекарств: Бальверса". НАС. Управление по контролю за продуктами и лекарствами (FDA). 12 апреля 2019. В архиве из оригинала 27 сентября 2019 г.. Получено 24 ноября 2019.
 Эта статья включает текст из этого источника, который находится в всеобщее достояние.
Эта статья включает текст из этого источника, который находится в всеобщее достояние.
внешняя ссылка
- «Эрдафитиниб». Портал информации о наркотиках. Национальная медицинская библиотека США.
- «Пакет одобрения лекарственных средств: Бальверса (эрдафинитиб)». НАС. Управление по контролю за продуктами и лекарствами (FDA).
