Саркома Юингса - Википедия - Ewings sarcoma
| саркома Юинга | |
|---|---|
| Другие имена | Саркома Юинга, периферическая примитивная нейроэктодермальная опухоль, опухоль Аскина и семейство опухолей саркомы Юинга[1] |
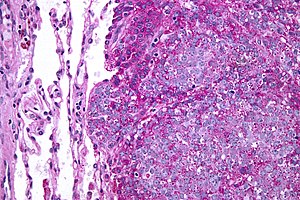 | |
| Микрофотография метастатической саркомы Юинга (справа от изображения) в норме легкое (слева от изображения). PAS пятно. | |
| Произношение | |
| Специальность | Онкология |
| Симптомы | Припухлость и боль возле опухоли[1] |
| Осложнения | Плевральный выпот, параплегия[2] |
| Обычное начало | От 10 до 20 лет[3][2] |
| Причины | Неизвестный[2] |
| Диагностический метод | Биопсия ткани[1] |
| Дифференциальная диагностика | Остеосаркома, нейробластома, остеомиелит, эозинофильная гранулема[2] |
| Уход | Химиотерапия, радиационная терапия, хирургия, трансплантация стволовых клеток[1] |
| Прогноз | Пятилетняя выживаемость ~ 70%[3] |
| Частота | 1 на миллион человек (США)[3] |
саркома Юинга это тип рак это может быть костная саркома или саркома мягких тканей.[1] Симптомы могут включать отек и боль на месте опухоли, высокая температура, а трещина в кости.[1] Чаще всего он начинается с ног, таз, и грудная стенка.[3] Примерно в 25% случаев рак уже распространяться на другие части тела на момент диагностики.[3] Осложнения могут включать: плевральный выпот или же параплегия.[2]
Причина саркомы Юинга неизвестна.[2] Большинство случаев происходит случайно.[2] Иногда его объединяют с примитивные нейроэктодермальные опухоли, в категории, известной как Семейство опухолей Юинга.[2] Основной механизм часто включает генетическое изменение, известное как реципрокная транслокация.[2] Диагноз ставится на основании биопсия опухоли.[1]
Лечение часто включает химиотерапия, радиационная терапия, хирургия и трансплантация стволовых клеток.[1] Таргетная терапия и иммунотерапия изучаются.[1] Пятилетняя выживаемость составляет около 70%.[3] Однако на эту оценку влияет ряд факторов.[3]
Джеймс Юинг в 1920 году установили, что опухоль представляет собой отдельный вид рака.[4][5] Он поражает примерно одного человека из миллиона в год в Соединенных Штатах.[3] Саркома Юинга чаще всего возникает у подростки и молодые люди и составляет 2% от детский рак.[1][2] Кавказцы страдают чаще, чем афро-американцы или азиаты.[3] Мужчины болеют чаще, чем женщины.[3]
Признаки и симптомы

Саркома Юинга чаще встречается у мужчин (1,6 мужчин: 1 женщина) и обычно проявляется в детстве или в раннем взрослом возрасте, с пиком между 10 и 20 годами. Это может произойти в любом месте тела, но чаще всего в таз и проксимальные длинные трубчатые кости, особенно вокруг пластинок роста. В диафизы из бедренная кость являются наиболее распространенными сайтами, за которыми следуют большеберцовая кость и плечевая кость. Тридцать процентов открыто метастатический на презентации. Люди обычно испытывают сильную боль в костях. В редких случаях может развиться во влагалище.[6][7]
Признаки и симптомы включают прерывистый лихорадка, анемия, лейкоцитоз, повысился скорость осаждения и другие симптомы воспалительного системного заболевания.[8]
Согласно Фонд исследования рака костей (BCRT) наиболее частыми симптомами являются локализованная боль, отек и спорадическая боль в костях различной интенсивности. Опухоль, скорее всего, будет видна, если саркома расположена на кости у поверхности тела, но когда она возникает в других местах, более глубоко в теле, например, на тазу, она может быть не видна.[9]
Генетика
Генетический обмен между хромосомами может привести к тому, что клетки станут злокачественными. Большинство случаев саркомы Юинга (85%) являются результатом перемещение между хромосомами 11 и 22, что объединяет EWSR1 ген хромосома 22 к FLI1 ген хромосома 11.[8]
Полногеномное ассоциативное исследование (GWAS) выявило три локуса восприимчивости, расположенные на хромосомах 1, 10 и 15.[10] Продолжительное исследование показало, что ген восприимчивости к саркоме Юинга EGR2, который расположен в локусе восприимчивости хромосомы 10, регулируется EWSR1-FLI1 онкоген слияния через GGAA-микросателлит.[11][12]
EWS / FLI функционирует как главный регулятор.[13] Остальные транслокации находятся в t (21; 22)[14] и t (7; 22).[15] Клетки саркомы Юинга положительны на CD99 и MIC2,[8] и отрицательный для CD45.[16]
Диагностика

Окончательный диагноз ставится на основании: гистоморфологический результаты, иммуногистохимия и молекулярная патология.
Саркома Юинга - это мелко-синяя круглоклеточная опухоль который обычно имеет чистую цитоплазму на Окрашивание H&E, из-за гликоген. Наличие гликогена может быть продемонстрировано положительным Окрашивание PAS и отрицательный PAS диастаза окрашивание. Характеристика иммуноокрашивание является CD99, который диффузно маркирует клеточная мембрана. Однако, поскольку CD99 не специфичен для саркомы Юинга, для подтверждения гистологического диагноза можно использовать несколько вспомогательных иммуногистохимических маркеров.[17] Морфологические и иммуногистохимические данные подтверждаются ассоциированными хромосомная транслокация, из которых несколько встречаются. Наиболее частая транслокация, присутствующая примерно в 90% случаев саркомы Юинга, - это t (11; 22) (q24; q12),[18][19] который генерирует аберрантный фактор транскрипции за счет слияния EWSR1 ген с FLI1 ген.[20]
Патологический дифференциальный диагноз - это группа опухолей с синими круглыми клетками, которая включает: лимфома, альвеолярный рабдомиосаркома, и десмопластическая мелкоклеточная опухоль, среди прочего.[нужна цитата ]
Медицинская визуализация
Эта секция нужны дополнительные цитаты для проверка. (Февраль 2019 г.) (Узнайте, как и когда удалить этот шаблон сообщения) |

На обычных рентгенограммы, наиболее частым костным представлением является проницаемое литическое поражение с периостальная реакция. Классическое описание пластинчатой периостальной реакции или периостальной реакции типа «луковица» часто связано с этим поражением. Обычные фильмы добавляют ценную информацию при первоначальной оценке или просмотре. Широкая переходная зона (например, проницаемая) является наиболее полезной характеристикой плоской пленки для дифференциации доброкачественных и агрессивных или злокачественных литических поражений.

Магнитно-резонансная томография (МРТ) следует регулярно использовать при лечении злокачественных опухолей. Он покажет полную протяженность костных и мягких тканей и соотнесет опухоль с другими близлежащими анатомическими структурами (например, сосудами). Гадолиний контраст не является необходимым, поскольку он не дает дополнительной информации по сравнению с неконтрастными исследованиями, хотя некоторые современные исследователи утверждают, что динамическая МРТ с контрастным усилением может помочь определить степень некроза в опухоли, что поможет определить реакцию на лечение до операции.
Компьютерная аксиальная томография (КТ) также можно использовать для определения внекостного распространения опухоли, особенно в черепе, позвоночнике, ребрах и тазу. И КТ, и МРТ могут использоваться для отслеживания реакции на радиацию и / или химиотерапия. Кость сцинтиграфия также можно использовать для отслеживания ответа опухоли на терапию.
В группе злокачественных мелкоклеточных опухолей, включающей саркому Юинга, костную лимфому и мелкоклеточную остеосаркому, кора головного мозга на рентгенограммах может казаться почти нормальной, в то время как проницаемый рост происходит через гаверсовы каналы. Эти опухоли могут сопровождаться большой массой мягких тканей, при этом почти не видно разрушения костей. Рентгенограммы часто не показывают признаков деструкции коры.
Рентгенологически саркома Юинга представляет собой «изъеденные молью» деструктивные просветы мозгового вещества и эрозию коры с расширением.
Дифференциальная диагностика
Другие субъекты с аналогичными клиническими проявлениями включают: остеомиелит, остеосаркома (особенно телеангиэктатическая остеосаркома) и эозинофильная гранулема. Новообразования мягких тканей, такие как плеоморфная недифференцированная саркома (злокачественная фиброзная гистиоцитома), которые разрушают соседнюю кость, также могут иметь похожий вид. Накапливающиеся данные свидетельствуют о том, что EWSR1-NFATc2-положительные саркомы, которые ранее считались, возможно, принадлежащими к семейству опухолей Юинга, отличаются от саркомы Юинга по своей генетике, транскриптомам, эпигентным и эпидемиологическим профилям, что указывает на то, что они могут представлять собой отдельную опухоль.[21][22][23][24]
Уход
Почти все люди получают несколько лекарств. химиотерапия (чаще всего винкристин, доксорубицин, циклофосфамид, ифосфамид, и этопозид ),[25] а также местный контроль заболевания с помощью хирургии и / или облучения.[26] Необходим агрессивный подход, потому что почти все люди с явно локализованным заболеванием на момент постановки диагноза действительно имеют бессимптомное метастатическое заболевание.[нужна цитата ]
Хирургическая резекция может включать спасение конечности или ампутация. Полное иссечение во время биопсии может быть выполнено, если злокачественное новообразование подтверждается во время исследования.[нужна цитата ] Продолжительность лечения варьируется в зависимости от локализации и стадии заболевания на момент постановки диагноза. Радикальная химиотерапия может длиться всего шесть сеансов с трехнедельным циклом, но большинство людей проходят химиотерапию в течение 6–12 месяцев и лучевую терапию в течение 5–8 недель.[нужна цитата ] Лучевая терапия использовалась при локализованном заболевании. Опухоль обладает уникальной способностью быть очень чувствительной к радиации, что иногда подтверждается фразой «тает, как снег», но главный недостаток заключается в том, что через некоторое время она резко рецидивирует.[нужна цитата ]
Антисмысловые олигодезоксинуклеотиды были предложены в качестве возможного лечения путем подавления экспрессии онкогенного гибридного белка, связанного с развитием саркомы Юинга в результате транслокации гена EWS-ETS.[27][28] Кроме того, сообщалось, что синтетическое производное ретиноида фенретинид (4-гидрокси (фенил) ретинамид) вызывает высокий уровень гибели клеток в клеточных линиях саркомы Юинга. in vitro и задержать рост ксенотрансплантатов в in vivo модели мышей.[29][30]
При большинстве онкологических заболеваний у детей, включая саркому, облучение пучком протонов (также известное как протонная терапия ) доставляет столь же эффективную дозу в опухоль с меньшим повреждением окружающей нормальной ткани по сравнению с фотонным излучением.[31]
Прогноз
Постановка попыток отличить людей с локализованным заболеванием от людей с метастатическим заболеванием.[32] Чаще всего, метастазы найти в легких, кости и / или костном мозге. Менее распространенные сайты включают Центральная нервная система и лимфатический узел.[нужна цитата ]
Пятилетняя выживаемость при локализованном заболевании после терапии превышает 70%.[33] До использования комбинированной химиотерапии длительная выживаемость составляла менее 10%. Развитие мультидисциплинарной терапии с химиотерапией, облучением и хирургией увеличило текущие показатели долгосрочной выживаемости в большинстве клинических центров до более чем 50%.[34] Однако по некоторым источникам она составляет 25–30%.[35]
Ретроспективные исследования показали, что два хемокиновых рецептора, CXCR4 и CXCR7, могут использоваться в качестве факторов молекулярного прогноза. Люди, которые экспрессируют низкие уровни обоих хемокиновых рецепторов, имеют самые высокие шансы на долгосрочную выживаемость с выживаемостью> 90% через пять лет после постановки диагноза по сравнению с выживаемостью <30% через пять лет для пациентов с очень высокими уровнями экспрессии обоих рецепторов.[36] Недавнее исследование также показало роль SOX2 в качестве независимого прогностического биомаркера, который можно использовать для выявления пациентов с высоким риском рецидива опухоли.[37]
Эпидемиология
Саркомы Юинга составляют 16% первичных сарком костей.[8] В США они чаще всего встречаются во втором десятилетии жизни,[8] со скоростью 0,3 случая на миллион у детей в возрасте до 3 лет и до 4,6 случая на миллион у подростков в возрасте 15–19 лет. В международном масштабе годовой уровень заболеваемости составляет менее 2 случаев на миллион детей.[38]
В Соединенном Королевстве ежегодно диагностируется в среднем шесть детей, в основном мужчины на ранних стадиях полового созревания. Из-за того, что диагноз чаще всего диагностируется в подростковом возрасте, может существовать связь между началом полового созревания и ранними стадиями этого заболевания, хотя никакие исследования не подтверждают эту гипотезу.[нужна цитата ]
Группе из трех не связанных между собой подростков в Уэйк-Форест, Северная Каролина, была диагностирована саркома Юинга. Всем трем детям был поставлен диагноз в 2011 году, и все они вместе посещали один и тот же временный класс, пока в школе проводился ремонт. Четвертому подростку, живущему поблизости, был поставлен диагноз в 2009 году. Вероятность попадания в эту группу считается значительной.[39] Саркома Юинга встречается примерно в 10-20 раз чаще у людей европейского происхождения по сравнению с людьми африканского происхождения.[40]
Саркома Юинга является вторым по распространенности раком костей у детей и подростков с плохим прогнозом и исходом примерно в 70% первичных диагнозов и в 10–15% рецидивов.[41]
Рекомендации
- ^ а б c d е ж грамм час я j «Лечение саркомы Юинга». Национальный институт рака. 25 января 2019 г.. Получено 3 февраля 2019.
- ^ а б c d е ж грамм час я j «Саркома Юинга». NORD (Национальная организация по редким заболеваниям). 2013. Получено 4 февраля 2019.
- ^ а б c d е ж грамм час я j «Лечение саркомы Юинга». Национальный институт рака. 31 января 2019 г.. Получено 4 февраля 2019.
- ^ "Саркома Юинга". Whonamedit. Получено 4 февраля 2019.
- ^ Юинг Дж (сентябрь 2006 г.). «Классика: диффузная эндотелиома кости. Труды Нью-Йоркского патологического общества. 1921; 12:17». Клиническая ортопедия и смежные исследования. 450: 25–7. Дои:10.1097 / 01.blo.0000229311.36007.c7. PMID 16951641.
- ^ «Опухоли влагалища; Глава шестая» (PDF). Международное агентство по изучению рака, Всемирная организация здравоохранения. С. 291–311. Архивировано из оригинал (PDF) на 2015-09-08. Получено 2018-03-14.
- ^ «Опухоли вульвы и влагалища: обзор». Атлас генетики и цитогенетики в онкологии и гематологии. В архиве из оригинала от 22.02.2018. Получено 2018-03-14.
- ^ а б c d е Гольдман Л., Сесил Р.Л., Шафер А.И. (2012). Goldman's Cecil Medicine (24-е изд.). Филадельфия: Эльзевьер Сондерс. п. 1326. ISBN 978-1-4377-2788-3. OCLC 909785616.
- ^ «Симптомы саркомы Юинга». Фонд исследования рака костей. Октябрь 2010. Архивировано с оригинал на 2013-01-30. Получено 2012-11-05.
- ^ Постель-Вине С., Верон А.С., Тирод Ф., Пьерон Дж., Рейно С., Ковар Х. и др. (Февраль 2012 г.). «Общие варианты рядом с TARDBP и EGR2 связаны с предрасположенностью к саркоме Юинга». Природа Генетика. 44 (3): 323–7. Дои:10,1038 / нг.1085. PMID 22327514. S2CID 205343425.
- ^ Грюневальд Т.Г., Бернар В., Жиларди-Хебенстрайт П., Рейнал В., Сурдез Д., Айно М. М. и др. (Сентябрь 2015 г.). «Химерный EWSR1-FLI1 регулирует ген восприимчивости к саркоме Юинга EGR2 через микросателлит GGAA». Природа Генетика. 47 (9): 1073–8. Дои:10,1038 / нг.3363. ЧВК 4591073. PMID 26214589.
- ^ Гомес NC, Дэвис Эй Джей (сентябрь 2015 г.). «Связь зародышевой линии и соматических вариаций в саркоме Юинга». Природа Генетика. 47 (9): 964–5. Дои:10,1038 / нг.3387. PMID 26313223. S2CID 5454861.
- ^ Оуэн Л.А., Ковалевски А.А., Лессник С.Л. (апрель 2008 г.). «EWS / FLI опосредует репрессию транскрипции через NKX2.2 во время онкогенной трансформации в саркоме Юинга». PLOS ONE. 3 (4): e1965. Bibcode:2008PLoSO ... 3.1965O. Дои:10.1371 / journal.pone.0001965. ЧВК 2291578. PMID 18414662.
- ^ Соренсен PH, Лессник С.Л., Лопес-Террада Д., Лю XF, Триче Т.Дж., Денни С.Т. (февраль 1994 г.). «Вторая транслокация саркомы Юинга, t (21; 22), сливает ген EWS с другим фактором транскрипции семейства ETS, ERG». Природа Генетика. 6 (2): 146–51. Дои:10.1038 / ng0294-146. PMID 8162068. S2CID 19747268.
- ^ Чон И.С., Дэвис Дж. Н., Браун Б. С., Сублетт Дж. Э., Руссель М. Ф., Денни С. Т., Шапиро Д. Н. (март 1995 г.). «Вариант транслокации саркомы Юинга (7; 22) объединяет ген EWS с геном ETS ETV1». Онкоген. 10 (6): 1229–34. PMID 7700648.
- ^ Бернштейн М., Ковар Х., Паулюссен М., Рэндалл Р.Л., Шук А., Теот Л.А., Юргенс Х. (май 2006 г.). "Семья опухолей саркомы Юинга: текущее лечение". Онколог. 11 (5): 503–19. Дои:10.1634 / теонколог.11-5-503. PMID 16720851.
- ^ МакКистон А., Епископ Дж. А. (март 2018 г.). «Полезность иммуногистохимии NKX2.2 для отличия саркомы Юинга от других синоназальных небольших круглых синих клеточных опухолей». Патология головы и шеи. 12 (1): 89–94. Дои:10.1007 / s12105-017-0830-1. ЧВК 5873485. PMID 28616785.
- ^ «Опухоли мягких тканей: опухоли Юинга / Примитивные нейроэктодермальные опухоли (PNET)». Атлас генетики и цитогенетики в онкологии и гематологии. Архивировано из оригинал 29 октября 2012 г.. Получено 5 ноября 2012.
- ^ Turc-Carel C, Aurias A, Mugneret F, Lizard S, Sidaner I, Volk C, Thiery JP, Olschwang S, Philip I, Berger MP (июнь 1988 г.). «Хромосомы в саркоме Юинга. I. Оценка 85 случаев замечательной последовательности t (11; 22) (q24; q12)». Генетика и цитогенетика рака. 32 (2): 229–38. Дои:10.1016/0165-4608(88)90285-3. PMID 3163261.
- ^ Delattre O, Zucman J, Plougastel B, Desmaze C, Melot T, Peter M, Kovar H, Joubert I, de Jong P, Rouleau G (сентябрь 1992 г.). «Слияние генов с ДНК-связывающим доменом ETS, вызванное транслокацией хромосом в опухолях человека». Природа. 359 (6391): 162–5. Bibcode:1992Натура.359..162D. Дои:10.1038 / 359162a0. PMID 1522903. S2CID 4331584.
- ^ Грюневальд Т.Г., Сидре-Араназ Ф., Сурдез Д., Томазу Э.М., де Алава Э., Ковар Х. и др. (Июль 2018). «Саркома Юинга». Обзоры природы. Праймеры для болезней. 4 (1): 5. Дои:10.1038 / с41572-018-0003-х. PMID 29977059. S2CID 49571421.
- ^ Koelsche C, Hartmann W, Schrimpf D, Stichel D, Jabar S, Ranft A и др. (Август 2018 г.). «Профилирование ДНК-метилирования на основе массива в саркомах с гистологией маленьких синих круглых клеток дает ценную диагностическую информацию». Современная патология. 31 (8): 1246–1256. Дои:10.1038 / с41379-018-0045-3. PMID 29572501.
- ^ Baldauf MC, Gerke JS, Orth MF, Dallmayer M, Baumhoer D, de Alava E, et al. (Июнь 2018). «Являются ли EWSR1-NFATc2-положительные саркомы действительно саркомами Юинга?». Современная патология. 31 (6): 997–999. Дои:10.1038 / с41379-018-0009-7. PMID 29895896.
- ^ Уотсон С., Перрен В., Гиймо Д., Рейно С., Койндр Дж. М., Караньян М. и др. (Май 2018). «Транскриптомное определение молекулярных подгрупп малых круглоклеточных сарком». Журнал патологии. 245 (1): 29–40. Дои:10.1002 / path.5053. PMID 29431183.
- ^ Лахл М., Фишер В.Л., Лашингер К. (февраль 2008 г.). «Семейство опухолей саркомы Юинга: обзор от диагностики до выживания». Клинический журнал медсестер онкологии. 12 (1): 89–97. Дои:10.1188 / 08.CJON.89-97. PMID 18258578. S2CID 10512706.
- ^ Рэндалл Л., Калверт Г., Спрейкер Х, Лессник С. (2005). "Семейство опухолей саркомы Юинга (ESFT)". Инициатива Лидди Шрайвер по саркоме. В архиве из оригинала от 08.02.2009. Получено 2009-04-15.
- ^ Асами С., Чин М., Шичино Х., Ёсида Ю., Немото Н., Мугишима Х., Судзуки Т. (март 2008 г.). «Лечение саркомы Юинга с использованием антисмыслового олигодезоксинуклеотида для регулирования клеточного цикла». Биологический и фармацевтический бюллетень. 31 (3): 391–4. Дои:10.1248 / bpb.31.391. PMID 18310898.
- ^ Матео-Лозано С., Гохале П.С., Солдатенков В.А., Дритчило А., Тирадо О.М., Notario V (ноябрь 2006 г.). «Комбинированное транскрипционное и трансляционное нацеливание EWS / FLI-1 при саркоме Юинга». Клинические исследования рака. 12 (22): 6781–90. Дои:10.1158 / 1078-0432.CCR-06-0609. PMID 17121899. S2CID 1404471.
- ^ Myatt SS, Redfern CP, Burchill SA (апрель 2005 г.). «p38MAPK-зависимая чувствительность опухолей семейства саркомы Юинга к гибели клеток, вызванной фенретинидом». Клинические исследования рака. 11 (8): 3136–48. Дои:10.1158 / 1078-0432.CCR-04-2050. PMID 15837770.
- ^ Myatt SS, Burchill SA (февраль 2008 г.). «Чувствительность опухолей семейства саркомы Юинга к гибели клеток, вызванной фенретинидом, увеличивается за счет EWS-Fli1-зависимой модуляции активности p38 (MAPK)». Онкоген. 27 (7): 985–96. Дои:10.1038 / sj.onc.1210705. PMID 17700534.
- ^ Ладра М.М., Йок Т.И. (январь 2014 г.). «Протонная лучевая терапия детской саркомы». Рак. 6 (1): 112–27. Дои:10.3390 / раки6010112. ЧВК 3980591. PMID 24424260.
- ^ McTiernan AM, Cassoni AM, Driver D, Michelagnoli MP, Kilby AM, Whelan JS (2006). «Улучшение результатов после рецидива саркомы Юинга: анализ 114 пациентов из одного учреждения». Саркома. 2006: 1–8. Дои:10.1155 / SRCM / 2006/83548. ЧВК 1698143. PMID 17496997.
- ^ "Как устроена стадия опухолей в семье Юинга?". Американское онкологическое общество. 19 июня 2006 г. Архивировано с оригинал 22 апреля 2008 г.
- ^ Ивамото Y (февраль 2007 г.). «Диагностика и лечение саркомы Юинга». Японский журнал клинической онкологии. 37 (2): 79–89. Дои:10.1093 / jjco / hyl142. PMID 17272319.
- ^ Такер М.М., Темпл Х.Т., Скалли С.П. (апрель 2005 г.). «Текущее лечение саркомы Юинга». Экспертный обзор противоопухолевой терапии. 5 (2): 319–31. Дои:10.1586/14737140.5.2.319. PMID 15877528. S2CID 26773908.
- ^ Беннани-Баити И.М., Купер А., Лоулор Э.Р., Кауэр М., Бан Дж., Арье Д.Н., Ковар Х. (июль 2010 г.). «Коанализ межкогортной экспрессии генов показывает, что хемокиновые рецепторы являются прогностическими индикаторами саркомы Юинга». Клинические исследования рака. 16 (14): 3769–78. Дои:10.1158 / 1078-0432.CCR-10-0558. ЧВК 2905506. PMID 20525755.
- ^ Саннино Г., Маркетто А., Ранфт А., Джабар С., Захерл С., Альба-Рубио Р., Штейн С., Вехвек Ф. С., Киран М. М., Хелтинг Т. Л., Муса Дж. (17 декабря 2018 г.). «Экспрессия SOX2 определяет пациентов с саркомой Юинга с высоким риском рецидива опухоли и плохой выживаемостью». bioRxiv: 498253. Дои:10.1101/498253.
- ^ Визуализация саркомы Юинга в eMedicine
- ^ «Трое студентов Wake борются с редким раком: кластер или совпадение?». WRAL.com. 29 апреля 2013 г. В архиве из оригинала на 2013-05-01. Получено 2013-04-30.
- ^ Worch J, Cyrus J, Goldsby R, Matthay KK, Neuhaus J, DuBois SG (март 2011 г.). «Расовые различия в частоте возникновения мезенхимальных опухолей, связанных с транслокацией EWSR1». Эпидемиология, биомаркеры и профилактика рака. 20 (3): 449–53. Дои:10.1158 / 1055-9965.EPI-10-1170. ЧВК 3051020. PMID 21212061.
- ^ Twardziok M, Kleinsimon S, Rolff J, Jäger S, Eggert A, Seifert G, Delebinski CI (2016). «Множественные активные соединения из Viscum album L. синергетически сходятся, способствуя апоптозу при саркоме Юинга». PLOS ONE. 11 (9): e0159749. Bibcode:2016PLoSO..1159749T. Дои:10.1371 / journal.pone.0159749. ЧВК 5010293. PMID 27589063.
дальнейшее чтение
- ван дер Вуде HJ, Smithuis R. «Опухоли костей - Дифференциальный диагноз». Радиологическое отделение больницы Onze Lieve Vrouwe Gasthuis в Амстердаме и больницы Рейнланд. Лейдердорп, Нидерланды.
- "Семейство опухолей Юинга". Словарь терминов NCI по раку. 2011-02-02.
внешняя ссылка
| Классификация | |
|---|---|
| Внешние ресурсы |
