Глицеронеогенез - Glyceroneogenesis
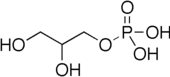

Глицеронеогенез это метаболический путь который синтезирует глицерин 3-фосфат или же триглицерид из прекурсоров, кроме глюкоза.[1] Обычно глицерин-3-фосфат образуется из глюкозы путем гликолиз, но когда концентрация глюкозы падает в цитозоль, он генерируется другим путем, называемым глицеронеогенезом. Глицеронеогенез использует пируват, аланин, глутамин или любые вещества из Цикл TCA в качестве предшественников глицерин-3-фосфата. Фосфоенолпируваткарбоксикиназа (PEPC-K),[1] который является фермент что катализирует декарбоксилирование из оксалоацетат к фосфоенолпируват является основным регулятором этого пути. Глицеронеогенез можно наблюдать в жировая ткань а также печень. Это важный биохимический путь, регулирующий цитозольный липид уровни. Интенсивное подавление глицеронеогенеза может привести к нарушение обмена веществ Такие как диабет 2 типа.[2]
Резюме
У млекопитающих триглицерин или его основа, глицерин-3-фосфат, обычно синтезируется из глюкозы путем гликолиза.[1] Глюкоза будет разлагаться за счет гликолиза до тех пор, пока фруктозо-1,6-бисфосфат разбивается на глицеральдегид-3-фосфат и дигидроксиацетонфосфат. Дигидроксиацетонфосфат играет важную роль в синтезе триглицеридов, поскольку его можно использовать для образования глицерин-3-фосфата. Однако глицерин-3-фосфат образуется другим путем, когда организм испытывает дефицит углеводы например глюкоза. Во время голодания или низкоуглеводной диеты глицерин-3-фосфат вырабатывается другим метаболическим путем, называемым глицеронеогенезом, который использует предшественники кроме глюкозы. Глицеронеогенез очень важен, поскольку это основной путь образования липидов во время голодания или голодания. Он не только производит липиды для организма, но также регулирует уровень липидов в клетка.[1] Глицеронеогенез включает повторную этерификацию жирные кислоты для выработки триглицеридов. Другими словами, он может регулировать концентрацию жирных кислот в цитозоле. Сильная активность в глицеронеогенезе будет вызывать повторную этерификацию жирных кислот, что приведет к снижению концентрации жирных кислот в цитозоле. Следовательно, глицеронеогенез в значительной степени связан с липидным контролем млекопитающие.
Метаболический путь


Основными предшественниками глицеронеогенеза являются: пируват, лактат, глутамин, и аланин. Глицеронеогенез также известен как разветвленный путь глюконеогенез потому что первые несколько шагов в глицеронеогенезе точно такие же, как и глюконеогенез (рис. 3).
Когда пируват или лактат используются в качестве предшественника глицерин-3-фосфата, глицеронеогенез идет по тому же пути, что и глюконеогенез, до тех пор, пока не образуется дигидроксиацетонфосфат. Лактат, катализируемый лактатдегидрогеназа образует пируват за счет НАД +. Кроме того, используя 1 АТФ и бикарбонат, пируват будет преобразован в оксалоацетат. который катализируется пируваткарбоксилаза. Оксалоацетат будет катализироваться PEPC-K для генерирования фосфоенолпируват. Этот фосфорилирование и декарбоксилирование оксалоацетата является важной стадией глицеронеогенеза, поскольку весь путь регулируется этой реакцией. После производства фосфоенолпирувата, глюконеогенез будет продолжаться до тех пор, пока не образуется дигидроксиацетонфосфат, который производит 2-фосфоглицерат, 3-фосфоглицерат, 1,3-бисфосфоглицерат и глицеральдегид-3-фосфат в качестве промежуточных продуктов. Когда дигидроксиацетонфосфат продуцируется, глицеронеогенез ответвляется от глюконеогенеза.[1] За счет НАДН дигидроксиацетонфосфат превратится в глицерин-3-фосфат (рис. 4), который является конечным продуктом глицеронеогенеза. Кроме того, триглицерид можно получить путем повторной этерификации 3 цепей жирных кислот на глицерин-3-фосфате. Следовательно, глицеронеогенез - это метаболический путь, начинающийся с лактата или пирувата, и он похож на глюконеогенез, но этот путь будет разветвляться при образовании дигидроксиацетонфосфата. Вместо производства фруктозо-1,6-бисфосфата, как при глюконеогенезе, при глицеронеогенезе дигидроксиацетонфосфат превращается в глицерин-3-фосфат.
Аланин также можно использовать в качестве предшественника глицеронеогенеза, поскольку аланин может расщепляться до пирувата. Аланин разлагается до пирувата, передавая свой аминогруппа к 2-оксоглутарат с ферментом под названием аланинаминотрансфераза. Аланинаминотрансфераза отщепляет аминогруппу от аланина и связывает ее с 2-оксоглутаратом, который образует пируват из аланина и глутамат из 2-оксоглутарата. Пируват, образующийся из аланина, вступает в глицеронеогенез и генерирует глицерин-3-фосфат.
Глутамат также является известным метаболитом, который может вступать в глицеронеогенез. Поскольку ключевой реакцией глицеронеогенеза является декарбоксилирование и фосфорилирование оксалоацетата до фосфоенолпирувата, теоретически любой биохимический путь, который генерирует оксалоацетат, связан с глицеронеогенезом. Например, глутамат может образовывать оксалоацетат в 2 этапа. Прежде всего, глутамат может быть преобразован в 2-оксоглутарат за счет NAD + и H2O с помощью глутаматдегидрогеназа. Во-вторых, 2-оксоглутарат может входить в цикл трикарбоксиловой кислоты с образованием оксалоацетата. Следовательно, теоретически любой метаболиты в цикле TCA или любые метаболиты, образующие метаболиты цикла TCA, могут использоваться в качестве предшественника глицеронеогенеза, но глутамат является единственным подтвержденным предшественником,
Регулирование

Фосфоенолпируваткарбоксикиназа (PEPC-K)
Глицеронеогенез можно регулировать двумя путями реакции. Прежде всего, он может регулироваться декарбоксилированием оксалоацетата до фосфоенолпирувата. Во-вторых, цикл TCA может влиять на глицеронеогенез, когда глутамат или субстраты в цикле TCA используются в качестве предшественника. Декарбоксилирование оксалоацетата до фосфоенолпирувата катализируется ферментом PEPC-K.[1] PEPC-K известен как важный фермент, регулирующий глицеронеогенез. Увеличение количества PEPC-K или чрезмерная экспрессия гена PEPC-K увеличивает активность глицеронеогенеза. Больше оксалоацетата можно декарбоксилировать до фосфоенолпирувата, когда больше PEPC-K может катализировать реакцию. Кроме того, экспрессия гена PEPC-K может подавляться гормоны названный норэпинефрин, глюкокортикоид, и инсулин.[3] Норэпинефрин это нейротрансмиттер гормон, который снижает активность PEPC-K, когда клетка ориентируется в холодной среде. В результате глицеронеогенез, скорее всего, снизится в активности в холодной среде. Глюкокортикоид - это стероидный гормон, который участвует во взаимной регуляции глицеронеогенеза в печени и жировой ткани. К сожалению, фактический механизм реципрокной регуляции не совсем понятен, но глюкокортикоиды индуцируют транскрипцию PEPC-K в печени, уменьшая транскрипцию в жировой ткани. Инсулин представляет собой пептидный гормон, который побуждает клетки усваивать глюкозу. В глицеронеогенезе инсулин подавляет экспрессию PEPC-K как в печени, так и в жировой ткани.
Цикл TCA
Когда метаболиты из цикла TCA или глутамат используются в качестве предшественника для глицеронеогенеза, регулятор в цикле TCA может также вызывать поток продуктов, образованных в результате глицеронеогенеза. Регуляция цикла TCA в основном определяется ингибированием продукта и доступностью субстрата. Цикл TCA замедляется, когда в окружающей среде присутствует избыток продукта или недостаток субстрата, например, ADP и НАД +
Место расположения
Поскольку глицеронеогенез связан с регуляцией липидов, его можно найти в жировая ткань и печень. В жировой ткани глицеронеогенез сдерживает высвобождение свободных жирных кислот за счет их повторной этерификации, а в печени триглицериды синтезируются для распределения липидов.
Белая жировая ткань
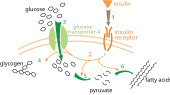
Белая жировая ткань, также известная как белый жир, является одним из двух типов жировой ткани у млекопитающих. Белая жировая ткань хранит энергию в виде триглицеридов, которые можно расщепить до свободных жирных кислот. Его нормальная функция заключается в хранении свободных жирных кислот в виде триглицеридов в тканях. Однако, когда уровень глюкозы в клетке падает в таких ситуациях, как голодание, белая жировая ткань генерирует глицерин-3-фосфат.[3] Наличие глицеронеогенеза в белых жировых тканях доказано экспериментом с мышь.[1] Поскольку глицерин-3-фосфат обычно образуется из глюкозы посредством гликолиза, уровень содержания триглицеридов сравнивали с нормальными мышами и мышами, которые не могут поглощать глюкозу своими клетками. Транспортер глюкозы 4, также известный как GLUT 4 (Рисунок 6) - белок-переносчик глюкозы, который потребляет внеклеточный глюкоза в внутриклеточный среда. Чтобы изучить наличие глицеронеогенеза у мышей, гены, экспрессирующие GLUT4, были удалены, и содержание триглицеридов в жировой ткани сравнивалось с нормальными мышами. Поскольку глюкоза не может попасть в клетку, ожидалось снижение синтеза глицерин-3-фосфата. Однако результат не показал изменения концентрации триглицеридов. Этот эксперимент доказал наличие альтернативного метаболического пути синтеза триглицеридов в жировой ткани мыши.[1] Кроме того, был проведен дополнительный эксперимент для изучения взаимосвязи альтернативного пути синтеза глицерин-3-фосфата и PEPC-K. Наблюдалось содержание триглицеридов в белой жировой ткани мышей с мутированным геном, экспрессирующим PEPC-K. Так как PEPC-K является важным регуляторным ферментом для глицеронеогенеза, мутации в генах PEPC-K могут снизить активность глицеронеогенеза. Результат показал отсутствие образования триглицеридов в белых жировых тканях, как ожидалось.[3] Следовательно, глицеронеогенез присутствовал в белых жировых тканях, потому что он был способен генерировать триглицериды без глюкозы и не мог синтезироваться, когда PEPC-K был мутирован. Следовательно, во время голодания или низкоуглеводной диеты белые жировые ткани генерируют глицерин-3-фосфат с помощью глицеронеогенеза.
Коричневая жировая ткань
Коричневая жировая ткань - это еще один тип жировой ткани, в которой хранятся свободные жирные кислоты. Коричневая жировая ткань особенно распространена у новорожденных млекопитающих и спящий млекопитающие. Разница между коричневой и белой жировой тканью заключается в том, что коричневая жировая ткань имеет более высокую активность в глицеронеогенезе, чем белая жировая ткань, а глицеронеогенез в коричневой жировой ткани связан с термогенез.[3] Активность глицеронеогенеза в коричневой жировой ткани выше, чем в белой жировой ткани, поскольку она содержит больше ферментов, участвующих в глицеронеогенезе. По сравнению с белой жировой тканью, коричневая жировая ткань имеет значительно более высокую активность PEPC-K и глицеринкиназы. Активность PEPC-K в коричневой жировой ткани почти в 10 раз превышает активность в белой жировой ткани.[3] PEPC-K, который участвует в превращении оксалоацетата в фосфоенолпируват, является ключевым ферментом, регулирующим глицеронеогенез. Увеличение активности фермента увеличит активность пути. Кроме того, не только PEPC-K, но и коричневая жировая ткань также богата активностью глицеринкиназы. Глицеринкиназа - это фермент, фосфорилирующий глицерин чтобы создать основу триглицеридов, глицерин-3-фосфат. Увеличение активности глицерин киназы приведет к увеличению продукции глицерин-3-фосфата. В результате коричневая жировая ткань будет иметь большую активность в глицеронеогенезе, потому что она содержит больше ферментов, участвующих в этом пути.

Кроме того, глицеронеогенез в коричневой жировой ткани связан с термогенезом в организме. У млекопитающих тепло генерируется за счет доставки свободных жирных кислот к митохондрии.[3] Когда глицеронеогенез протекает регулярно, концентрация свободных жирных кислот в межклеточной среде низкая, поскольку глицеронеогенез повторно этерифицирует жирные кислоты в триглицериды. Другими словами, термогенез под действием свободных жирных кислот с меньшей вероятностью происходит, когда идет глицеронеогенез. Однако при воздействии холода нейротрансмиттер гормон называется норэпинефрин подавит активность PEPC-K.[3] Когда активность PEPC-K подавлена, глицеронеогенез не сможет повторно этерифицировать свободные жирные кислоты. В конце концов, концентрация свободных жирных кислот в клетке увеличится, что приведет к избыточному содержанию свободных жирных кислот в цитозоле, которые, следовательно, будут доставляться в митохондрии для термогенеза.[4] Следовательно, когда млекопитающее подвергается воздействию холода, в коричневой жировой ткани выделяется тепло за счет снижения активности глицеронеогенеза.
Печень
Хотя глицеронеогенез был впервые обнаружен в жировой ткани, он не распознавался в печени до 1998 года (Источник?). Глицеронеогенез в печени был неожиданным по 2 причинам; Синтез триглицеридов в печени считался неестественным, потому что глюконеогенез играет огромную роль в печени, и считалось, что печень имеет достаточное количество глицерин-3-фосфата, собираемого из кровоток. Однако несколько экспериментов, в которых использовались стабильные изотопы Чтобы отслеживать глицерин в печени и кровотоке, было показано, что 65% глицериновой основы триглицеридов, протекающих с кровотоком, фактически синтезируется в печени.[3] Таким образом, был обнаружен синтез глицерин-3-фосфата в печени. Фактически, печень синтезирует более половины глицерина, который необходим млекопитающим для регулирования липидов в их организме.

Глицеронеогенез в печени и жировой ткани регулирует метаболизм липидов противоположным образом. С одной стороны, липиды в виде триглицеридов высвобождаются из печени. Однако, с другой стороны, глицеронеогенез ограничивает высвобождение жирных кислот из жировых тканей за счет их повторной этерификации. Другими словами, глицеронеогенез в печени и жировой ткани регулируется поочередно.[3] Когда концентрация липидов в крови относительно высока, глицеронеогенез в печени будет негативно регулироваться, чтобы остановить синтез триглицерида, но глицеронеогенез в жировой ткани будет индуцироваться, чтобы ограничить высвобождение свободных жирных кислот в кровоток. И наоборот, глицеронеогенез в печени будет индуцироваться и подавляться в жировой ткани, когда уровень липидов в крови низкий. Несмотря на то, что реципрокная регуляция глицеронеогенеза до конца не изучена, гормон, называемый глюкокортикоид является лучшим примером регулирования.[4] Глюкокортикоиды индуцируют транскрипцию гена PEPC-K в печени, но подавляют транскрипцию в жировой ткани.
Болезнь
Диабет 2 типа

Нарушение регуляции глицеронеогенеза может привести к Сахарный диабет 2 типа.[5] Диабет 2 типа - это нарушение обмена веществ вызвано высоким уровнем глюкозы в крови и липидов крови. Диабет 2 типа может быть вызван избыточной выработкой триглицеридов в печени из-за чрезмерно активного глицеронеогенеза или избыточным высвобождением жирных кислот из жировой ткани. Поскольку активность глицеронеогенеза в основном зависит от PEPC-K, колебания экспрессии PEPC-K будут резко влиять на активность глицеронеогенеза. Избыточная экспрессия PEPC-K в печени в конечном итоге приведет к избыточной выработке триглицеридов, что может повысить уровень липидов в кровотоке. И наоборот, в жировой ткани подавленный глицеронеогенез может вызвать диабет 2 типа. Подавление глицеронеогенеза приведет к увеличению свободных жирных кислот в жировых тканях, поскольку не будет происходить повторная этерификация свободных жирных кислот. Следовательно, чрезмерно индуцированный глицеронеогенез в печени и сниженный в жировой ткани может быть триггером диабета 2 типа.
Уход
Регулирование глицеронеогенеза является терапевтической мишенью диабета II типа. Выброс триглицеридов в печени должен быть подавленный а также высвобождение свободных жирных кислот в жировых тканях. Инсулин используется как понижающий регулятор глицеронеогенеза в печени. Подавление глицеронеогенеза снижает выброс триглицеридов в кровоток из печени. Однако проблема с инсулином в том, что он также подавляет глицеронеогенез в жировой ткани. Чтобы ограничить высвобождение свободной жирной кислоты из жировой ткани, жирные кислоты должны быть повторно этерифицированы путем глицеронеогенеза. Тиазолидиндион (Рисунок 8) - это вещество, которое влияет только на глицеронеогенез в жировой ткани. Тиазолидиндион увеличивает транскрипция PEPC-K и в конечном итоге индуцируют активность глицеронеогенеза.[5] В результате в клетке происходит повторная этерификация жирных кислот, которая предотвращает выброс жирных кислот в кровоток.[5]
Смотрите также
Рекомендации
- ^ а б c d е ж грамм час Най С.К., Хэнсон Р.В., Калхан СК (октябрь 2008 г.). «Глицеронеогенез является доминирующим путем синтеза триглицеридов глицерина in vivo у крыс». Журнал биологической химии. 283 (41): 27565–74. Дои:10.1074 / jbc.M804393200. ЧВК 2562054. PMID 18662986.
- ^ Jeoung NH, Harris RA (октябрь 2010 г.). «Роль киназы 4 пируватдегидрогеназы в регуляции уровня глюкозы в крови». Корейский журнал диабета. 34 (5): 274–83. Дои:10.4093 / kdj.2010.34.5.274. ЧВК 2972486. PMID 21076574.
- ^ а б c d е ж грамм час я Решеф Л., Олсванг И., Кассуто Х., Блюм Б., Кронигер С.М., Калхан С.К., Тилгман С.М., Хансон Р.В. (август 2003 г.). «Глицеронеогенез и цикл триглицерид / жирные кислоты». Журнал биологической химии. 278 (33): 30413–6. Дои:10.1074 / jbc.R300017200. PMID 12788931.
- ^ а б Чавес В.Е., Фрассон Д., Мартинс-Сантос М.Э., Бошини Р.П., Гарофало М.А., Фестучча В.Т., Кеттельхут IC, Мильорини Р.Х. (октябрь 2006 г.). «Глицеронеогенез снижается, а поглощение глюкозы увеличивается в жировой ткани у крыс, питающихся диетой из кафетерия, независимо от симпатической иннервации тканей». Журнал питания. 136 (10): 2475–80. Дои:10.1093 / jn / 136.10.2475. PMID 16988112.
- ^ а б c Бил Э. Г., Хаммер Р. Э., Антуан Б., Форест С. (апрель 2004 г.). «Нерегулируемый глицеронеогенез: PCK1 как кандидатный ген диабета и ожирения». Тенденции в эндокринологии и метаболизме. 15 (3): 129–35. Дои:10.1016 / j.tem.2004.02.006. PMID 15046742.
