Ladderane - Ladderane

В химия, а Ladderane является органическая молекула содержащие два или более сплавленных циклобутан кольца. Название происходит от сходства ряда конденсированных циклобутановых колец с лестница. Были разработаны многочисленные синтетические подходы для синтез ладдерановых соединений различной длины.[1] В механизмы часто вовлекают [2 + 2] фотоциклоприсоединения, полезная реакция для создания напряженных 4-членных колец. Встречающиеся в природе ладдераны были идентифицированы как основные компоненты анаммоксосомальной мембраны анаммокс бактерии Планктомицеты.[2]
Номенклатура
Длина цепочки
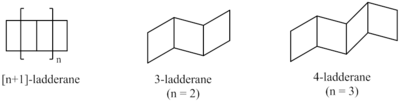
Синтетические подходы позволили получить лестницы различной длины. Была разработана система классификации для описания лестдеранов на основе количества последовательных колец.[3] Длина ладдерана обозначается числом в скобках перед словом «ладдеран». Это равно количеству связей двух циклобутанов (п) плюс 1.
Ладдеран из 3 или более единиц может соединяться по кругу, образуя ленту, которую также можно рассматривать как два соединенных параллельно циклоалкан кольца. Они называются присманес.
Стереохимия

B: анти- и син- [3] -ладдеран
Ладдераны имеют два типа стереохимический отношения.[3] Один описывает относительное расположение атомы водорода на слияние между двумя циклобутановыми кольцами. Эти атомы водорода могут находиться либо в цис- или транс- конфигурация. Транс-ладдераны не синтезированы из-за напряжение кольца в этих соединениях.
Второе стереохимическое соотношение описывает ориентацию трех последовательных циклобутановых колец и, следовательно, имеет отношение только к ладдеранам п ≥ 2. Два внешних кольца могут быть на одной поверхности (син-) или на противоположной поверхности (анти-) центрального кольца.
Синтез
Для лабораторного синтеза ладдерановых соединений использовались различные синтетические методы. Три основных подхода: (1) димеризация из полиен предшественники, (2) ступенчатое добавление, одно или два кольца за раз, (3) и олигомеризация.[3] Ниже приведены несколько примеров синтеза ладдеранов.
Димеризация циклобутадиена
Димеризация двух циклобутадиены может генерировать как син-, так и антиладдерановые продукты в зависимости от условий реакции.[4] Первая стадия образования син-продукта включает образование 1,3-циклобутадиена обработкой цис-3,4-дихлорциклобутена амальгама натрия. Реагент проходит через металлизированный средний перед образованием 1,3-циклобутадиена, который затем может димеризоваться с образованием син-диена. Гидрирование из двойные связи сформирует насыщенный син- [3] -ладдеран.
Для получения антипродукта цис-3,4-дихлорциклобутен обрабатывают литий амальгама.[5] Производное лития подвергается C-C реакция сочетания для получения открытой димерной структуры. Этот промежуточный продукт реагирует с образованием антидиена, который можно гидрогенизировать с образованием конечного анти- [3] -ладдеранового продукта.

Синтез [4] -почечникового диена
Другой синтетический подход, разработанный Мартином и сотрудниками, позволил синтез [4] -ладдеранов.[4] Начальная стадия включает образование [2] -ладдерана путем добавления двух эквивалентов малеиновый ангидрид с ацетилен. Остальные два кольца сформированы из Сжатие кольца Рамберга – Бэклунда.

Синтез длинноцепочечных ладдеранов
Ладдераны с длиной до 13 циклобутановых колец были синтезированы Мехтой с сотрудниками.[6] Этот процесс включает на месте образование дикарбометоксициклобутадиена из его Fe (CO)3 комплекс при низких температурах с добавлением цериевая (IV) аммиачная селитра (CAN). Генерация бутадиен быстро образует смесь [п] -ладдераны длиной до п = 13 с комбинезоном урожай 55%. Все ладдераны, синтезированные этим методом, имеют одну цис-, син-, цис-структуру. Это может быть результатом начальной димеризации двух циклобутадиенов, которая предпочтительно образует син-продукт, показанный ниже. Дальнейшая димеризация дает анти-продукт только из-за стерических факторов.

Димеризация предшественников полиенов
В этих реакциях ладдераны образуются из множественных [2 + 2] фотоциклоразрывов между двойными связями двух полиенов.[7] Сложность, возникающая при таком подходе, заключается в реакции прекурсоров через альтернативные, более благоприятные фотовозбуждение маршруты. Эти побочные реакции предотвращаются добавлением химического спейсера, который удерживает два полиена параллельно друг другу, позволяя только происходить [2 + 2] циклоприсоединениям.
Обычным спейсером, используемым в этих реакциях, является [2.2] парациклофан система. Он достаточно жесткий и может удерживать полиеновые хвосты на достаточно близком расстоянии, чтобы могли происходить циклоприсоединения.

МакГилливрей и его коллеги продемонстрировали, что супрамолекулярный подход к ковалентному синтезу в организованной среде твердого тела без растворителей может обеспечить решение проблемы организации двух полиенов для внутримолекулярной реакции с образованием ладдерана. В частности, применив подход к контролю реакционной способности в твердых телах с использованием молекул, которые служат линейными матрицами, они продемонстрировали полезность сокристаллизации резорцина (1,3-бензолдиола) или его производного с полностьютранс-бис (4-пиридил) поли-м-ен (4-пир-поли-м-ene) образует четырехкомпонентную молекулярную сборку, 2 (резорцин) · 2 (4-пир-поли-м-ene), в котором каждый резорцин преорганизует через два взаимодействия O-H ··· N с водородными связями два поли-м-ены для добавления фото [2 + 2]. Два полиена расположены шаблонами так, что связи C = C олефинов лежат параллельно и разделены на <4,2 Å, положение, подходящее для фотореакции. УФ-облучение твердого тела дает целевую [п] ладдеран, со связями C = C, реагирующими с образованием конденсированного циклобутанового каркаса. Широкополосное УФ-облучение двух таких связанных водородными связями четырехкомпонентных супрамолекулярных ансамблей дает соответствующие лестдераны стереоспецифически и с количественным выходом в граммах.[8]
Биологический фон

Ладдераны впервые были идентифицированы в редкой группе анаэробных окислителей аммония (анаммокс ) бактерии принадлежность к типу Планктомицеты. Эти бактерии изолируют катаболические реакции анаммокса во внутриклеточных компартментах, называемых анаммоксосомами.[2] Процесс анаммокса включает окисление из аммоний к газообразному азоту с нитрит как последний акцептор электронов. Промежуточными продуктами в этом процессе являются два высокотоксичных соединения: гидразин (N2ЧАС4) и гидроксиламин (NH2ОЙ). Процесс окисления включает образование протонный градиент на интрацитоплазматической стороне анаммоксосомы. Диссипация протонного градиента связана с фосфорилированием ADP через мембранный АТФазы.[9]
Анаммоксосомы обогащены ладдераном. липиды показано справа.[10] Анализ мембран анаммоксосом из видов бактерий Borcadia anammoxidans и Kuenenia stuttgartiensis выявил, что ладдераны составляют более 50% мембранных липидов. Высокое содержание ладдерановых липидов в анаммоксосомах приводит к исключительно плотной мембране с пониженной проницаемостью.[11] Пониженная проницаемость может снизить пассивная диффузия протонов через мембрану, которые рассеивают электрохимический градиент. Это будет особенно вредно для бактерий анаммокс из-за относительно медленного метаболизма анаммокса. Предполагается, что пониженная проницаемость связывает высокотоксичные и мутагенные промежуточные соединения, гидразин и гидроксиламин, которые могут легко диффундировать через биомембраны. Потеря этих ключевых промежуточных продуктов может повредить ключевые клеточные компоненты, такие как ДНК, а также снижают катаболическую эффективность клетки.
Синтез ладдерановых липидов
Липид природного происхождения [5] -ладдеран, названный пентациклоанаммоксической кислотой, был синтезирован Кори и коллеги.[12] Первый шаг в этой реакции включает бромирование с последующей циклизацией циклооктатетраен с образованием циклогексадиена. Этот циклогексадиен улавливается дибензилазодикарбоксилатом. Функциональная группа сделаны модификации для производства циклобутана, который получают [2 + 2] фотоциклоприсоединение с циклопентеноном с образованием второго циклобутанового кольца. Защита карбонильная группа, за которым следует N2 реакция экструзии дает еще два конденсированных цикла циклобутана. Конечный циклобутан образуется Перестановка Вольфа, а алкильная цепь установлена Олефинирование по Виттигу.
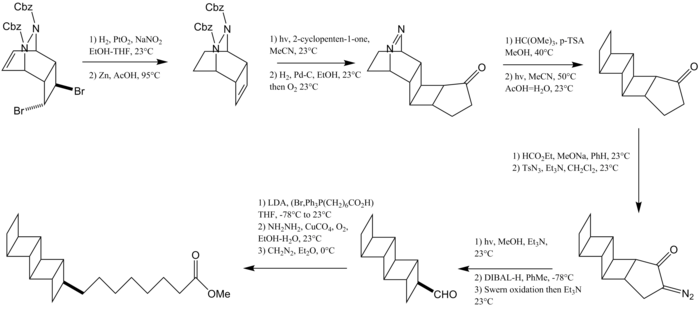
В 2016 году Бернс и его коллеги из Стэнфордского университета сообщили об энантиоселективном синтезе как [3] -, и [5] -ладдерановых липидных хвостов, так и об их включении в полноценный комплекс. фосфатидилхолин липид.[13]Оба пути используют небольшой строительный блок [2] -ладдерен бицикло [2.2.0] гексен, полученный Реакция Рамберга – Бэклунда. Путь к жирной кислоте, содержащей [5] -ладдеран, включает димеризацию этого промежуточного продукта с образованием полностьюанти [5] -ладдеран углеводород. C – H хлорирование марганцем порфирин катализатор и последующее удаление приводит к ненасыщенности с образованием [5] -ладдерена. Гидроборация и Реакция Цвайфеля установить линейную алкильную группу.

Путь к [3] -ладдерану жирного спирта начинается с [2 + 2] фотоциклоприсоединение между бромированным бензохинон и бицикло [2.2.0] гексен. Удаление H – Br и добавление цинкорганическое соединение устанавливает алкиловый спирт. А гидразин -опосредованная реакция деоксигенации с последующим гидрированием Катализатор Крэбтри снижает эффект до циклогексанового кольца.

Рекомендации
- ^ Хопф, Хеннинг; Джоэл Ф. Либман; Х. Марк Перкс (2009). «Кубаны, фенестраны, ладдераны, присманы, стаффаны и другие олигоциклобутаноиды». Химия функциональных групп PATAI. Дои:10.1002 / 9780470682531.pat0337. ISBN 9780470682531.
- ^ а б Фуэрст, Джон А. (23 мая 2005 г.). «Внутриклеточная компартментация у планктомицетов». Ежегодный обзор микробиологии. 59: 299–328. Дои:10.1146 / annurev.micro.59.030804.121258. PMID 15910279.
- ^ а б c Нури, Дастин Х .; Дин Дж. Тантилло (ноябрь 2006 г.). «Они пришли из глубин: синтез, применение и биология ладдеранов». Современная органическая химия. 10 (16): 2055–2074. Дои:10.2174/138527206778742678.
- ^ а б Хопф, Хеннинг (2003). «Шаг за шагом - от необычных к биологическим молекулярным лестницам». Angewandte Chemie International Edition. 42 (25): 2822–2825. Дои:10.1002 / anie.200301650. PMID 12833336.
- ^ Pettit, R .; Дж. Хенери (1970). «цис-3,4, -дихлорциклобутен». Органический синтез. 50: 36. Дои:10.15227 / orgsyn.050.0036.
- ^ Мехта, Говердхан; М. Баладжи Вишванатх; Аджит К. Кунвар (1994). "Характеристика [п] -Ладдераны беспрецедентной длины: новый рекорд для сплавленных карбоциклических массивов ». Журнал органической химии. 59 (21): 6131–6132. Дои:10.1021 / jo00100a002.
- ^ Грейвинг, Гельмут; Хеннинг Хопф; Питер Дж. Джонс; Питер Бубеничек; Жан-Пьер Десвернь; Анри Буа-Лоран (1994). «Синтез, фотофизические и фотохимические свойства четырех изомеров [2.2]« циннамофана »; высокоэффективное стереоспецифическое [2 + 2] фотоциклоприсоединение». Журнал химического общества, химические коммуникации (9): 1075–1076. Дои:10.1039 / C39940001075.
- ^ Макгилливрей, Л. Р. (2004). «Супрамолекулярная конструкция молекулярных лестниц в твердом состоянии». Энгью. Chem. Int. Эд. 43 (2): 232–236. Дои:10.1002 / anie.200352713. PMID 14695618.
- ^ ван Нифтрик, Лаура А .; Джон А. Фуэрст; Яап С. Синнингхе Дамсте; Дж. Гийс Куэнен; Майк С. М. Джеттен; Марк Строус (2004). «Анамоксосома: внутрицитоплазматический компартмент в анаммокс-бактериях». Письма о микробиологии FEMS. 233 (1): 7–13. Дои:10.1016 / j.femsle.2004.01.044. PMID 15098544.
- ^ Дамсте, Яап С. Синниге; Марк Строус; В. Ирен К. Риджпстра; Эллен К. Хопманс; Ян А. Дж. Гееневасен; Адри К. Т. ван Дуин; Лаура А. ван Нифтрик; Майк С. М. Джеттен (17 октября 2002 г.). «Линейно связанные липиды циклобутана образуют плотную бактериальную мембрану». Природа. 419 (6908): 708–712. Bibcode:2002Натура.419..708С. Дои:10.1038 / природа01128. PMID 12384695.
- ^ Moss, Frank R .; Shuken, Steven R .; Мерсер, Джарон А. М .; Коэн, Кэролайн М .; Weiss, Thomas M .; Боксер, Стивен Дж .; Бернс, Ноа З. (23.08.2018). «Фосфолипиды ладдерана образуют плотно упакованную мембрану с нормальным гидразином и аномально низкой проницаемостью для протонов / гидроксидов». Труды Национальной академии наук. 115 (37): 9098–9103. Дои:10.1073 / pnas.1810706115. ISSN 0027-8424. ЧВК 6140541. PMID 30150407.
- ^ Маскитти, Винсент; Э. Дж. Кори (11 ноября 1994 г.). «Полный синтез (±) -пентациклоанаммоксической кислоты». Журнал Американского химического общества. 126 (48): 15664–15665. Дои:10.1021 / ja044089a. PMID 15571387.
- ^ Мерсер, Джарон А. М .; Коэн, Кэролайн М .; Shuken, Steven R .; Вагнер, Анна М .; Smith, Myles W .; Moss, Frank R .; Смит, Мэтью Д.; Вахала, Рику; Гонсалес-Мартинес, Алехандро (14 декабря 2016 г.). «Химический синтез и самосборка ладдеранового фосфолипида». Журнал Американского химического общества. 138 (49): 15845–15848. Дои:10.1021 / jacs.6b10706. ISSN 0002-7863. ЧВК 5279923. PMID 27960308.
