Биоконъюгация - Bioconjugation
Биоконъюгация химическая стратегия для формирования стабильного ковалентная связь между двумя молекулами, по крайней мере одна из которых является биомолекула.
Функция
Последние достижения в понимании биомолекул сделали возможным их применение во многих областях, таких как медицина и материалы. Синтетически модифицированные биомолекулы могут иметь различные функции, такие как отслеживание клеточных событий, выявление фермент функция, определяющая белок биораспределение, визуализация конкретный биомаркеры, и доставка наркотики к целевым клеткам.[1][2][3][4] Биоконъюгация - это важная стратегия, которая связывает эти модифицированные биомолекулы с различными субстраты.
Синтез
Синтез биоконъюгатов включает в себя множество проблем, начиная от простого и неспецифического использования флуоресцентный краситель маркер к сложной конструкции конъюгаты антитела и лекарства.[1][3] В результате различные реакции биоконъюгации - химические реакции соединяющие две биомолекулы вместе - были разработаны для химической модификации белков. Обычными типами реакций биоконъюгирования белков являются связывание лизин аминокислотные остатки, соединение цистеин остатки, связывание тирозин остатки, модификация триптофан остатки и модификация N- и C- конец.[1][3][4]
Однако эти реакции часто отсутствуют. хемоселективность и эффективность, поскольку они зависят от присутствия нативных аминокислотных остатков, которые обычно присутствуют в больших количествах, что снижает селективность. Возрастает потребность в химических стратегиях, которые могут эффективно прикреплять синтетические молекулы к белкам. Одна из стратегий - сначала установить уникальный функциональная группа на белок, а затем биоортогональный или тип клика реакция используется для связывания биомолекулы с этой уникальной функциональной группой.[1] Биоортогональные реакции, нацеленные на ненативные функциональные группы, широко используются в химии биоконъюгирования. Некоторые важные реакции - это модификация кетон и альдегиды, Лигирование по Штаудингеру с участием азиды, с медным катализатором Циклоприсоединение Huisgen азидов, а штамм способствовал циклоприсоединению азидов по Хьюисгену.[5][6][7][8]
Общие реакции биоконъюгации
Наиболее распространенными биоконъюгациями являются связывание небольших молекул (таких как биотин или флуоресцентный краситель) с белком, или конъюгации белок-белок, такие как связывание антитела с ферментом.[9] Другими менее распространенными молекулами, используемыми в биоконъюгации, являются олигосахариды, нуклеиновых кислот, синтетические полимеры такие как полиэтиленгликоль,[10] и углеродные нанотрубки.[11] Конъюгаты антитело-лекарственное средство такие как Брентуксимаб ведотин и Гемтузумаб озогамицин также являются примерами биоконъюгации и являются активной областью исследований в фармацевтической промышленности.[12] В последнее время биоконъюгация также приобрела значение в нанотехнологии приложения, такие как биоконъюгированные квантовые точки.
Реакции остатков лизина
В нуклеофильный Остаток лизина обычно является сайтом-мишенью при биоконъюгации белков, обычно через амин -реактивный N-гидроксисукцинимидил (NHS) сложные эфиры.[3] Для получения оптимального количества депротонированный остатки лизина, pH из водный раствор должен быть ниже pKa лизина аммоний группы, которая составляет около 10,5, поэтому типичный pH реакции составляет около 8 и 9. Обычным реагентом для реакции сочетания является NHS-эфир (показан в первой реакции ниже в Рисунок 1), который реагирует с нуклеофильным лизином через лизин ацилирование механизм. Другие аналогичные реагенты изоцианаты и изотиоцианаты которые подвергаются аналогичному механизму (показано во второй и третьей реакциях в Рисунок 1 ниже).[1] Бензоил фториды (показаны в последней реакции ниже в Рисунок 1), что позволяет модифицировать белки лизином в мягких условиях (низкая температура, физиологические pH ), были недавно предложены в качестве альтернативы классическим лизинспецифическим реагентам.[13]

Реакции остатков цистеина
Поскольку свободный цистеин редко встречается на поверхности белка, он является отличным выбором для хемоселективной модификации.[14] При основных условиях остатки цистеина будут депротонированы с образованием тиолат нуклеофил, который будет реагировать с мягким электрофилы, такие как малеимиды и йодацетамиды (показаны в первых двух реакциях в фигура 2 ниже). В результате связь углерод-сера сформирован. Другая модификация остатков цистеина включает образование дисульфидная связь (показано в третьей реакции в фигура 2). В уменьшенный остатки цистеина реагируют с экзогенный дисульфиды, образуя новую дисульфидную связь на белке. Для запуска реакции часто используется избыток дисульфидов, таких как 2-тиопиридон и 3-карбокси-4-нитротиофенол.[1][3] Электронно-дефицитный алкины было продемонстрировано, что они избирательно реагируют с цистеиновыми остатками белков в присутствии других нуклеофильных аминокислотных остатков. В зависимости от замещения алкина эти реакции могут давать либо расщепляемый (при использовании производных алкинона), либо[15] или гидролитически стабильные биоконъюгаты (когда 3-арилпропиолонитрилы используются; последняя реакция ниже в фигура 2).[16]

Реакции остатков тирозина
Остатки тирозина относительно инертны; поэтому они не были популярными мишенями для биоконъюгирования. Недавние разработки показали, что тирозин можно модифицировать через электрофильные ароматические замещения (EAS) реакции, и он селективен для ароматный углерод, прилегающий к фенольный гидроксил группа.[1] Это становится особенно полезным в случае, когда остатки цистеина не могут быть нацелены. В частности, диазоний эффективно связывает с остатками тирозина (соль диазония показан как реагент в первой реакции в Рисунок 3 ниже), а электроноакцепторный заместитель в 4-м положении соль диазония может эффективно повысить эффективность реакции. Циклическое производное диазодикарбоксиамида, подобное 4-фенил-1,2,4-триазол-3,5-дион (PTAD) сообщалось о селективной биоконъюгации по остаткам тирозина (вторая реакция в Рисунок 3 ниже).[17] Трехкомпонентный Реакция типа Манниха с участием альдегиды и анилины (последняя реакция в Рисунок 3) также было описано, что он относительно селективен по тирозину в мягких оптимизированных условиях реакции.[18]

Реакции N- и C-концов
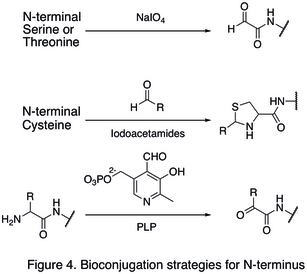
Поскольку природные аминокислотные остатки обычно присутствуют в больших количествах, часто бывает трудно изменить один единственный сайт. Были разработаны стратегии, нацеленные на концы белка, поскольку они значительно повышают избирательность сайта модификации белка. Одна из модификаций N-конца включает функционализация концевой аминокислоты. В окисление N-терминала серин и треонин остатки способны образовывать N-концевой альдегид, который может подвергаться дальнейшим биоортогональным реакциям (показано в первой реакции в Рисунок 4). Другой тип модификации включает конденсация N-концевого цистеина с альдегидом, образуя тиазолидин который стабилен при высоком pH (вторая реакция в Рисунок 4). С помощью пиридоксальфосфат (PLP), несколько N-концевых аминокислот могут подвергаться трансаминирование дать N-конец альдегид, такие как глицин и аспарагиновая кислота (третья реакция в Рисунок 4).
Примером модификации C-конца является нативная химическая перевязка (NCL), который представляет собой соединение между C-терминалом тиоэфир и N-концевой цистеин (Рисунок 5).

Биоортогональные реакции
Модификация кетонов и альдегидов
Кетон или альдегид могут быть присоединены к белку посредством окисления N-концевых остатков серина или трансаминирования с помощью PLP. Кроме того, они могут быть введены путем включения неприродные аминокислоты через Метод Тиррелла или Метод Шульца.[5] Затем они будут избирательно конденсироваться с алкоксиамином и гидразин, производя оксим и гидразон производные (показаны в первой и второй реакциях соответственно в Рисунок 6). Эта реакция очень хемоселективна с точки зрения биоконъюгации белков, но скорость реакции медленный. Механистические исследования показывают, что этап определения ставки это обезвоживание из тетраэдрический промежуточный, так что мягкий кислый раствор часто используется для ускорения стадии дегидратации.[2]

Введение нуклеофильного катализатора может значительно повысить скорость реакции (показано на Рисунок 7). Например, используя анилин в качестве нуклеофильного катализатора менее населенная протонированная карбонил становится густонаселенной протонированной База Шиффа.[19] Другими словами, он генерирует высокую концентрацию реактивного электрофила. После этого легко может происходить лигирование оксима, и сообщалось, что скорость увеличивалась до 400 раз в умеренно кислых условиях.[19] Ключ этого катализатора заключается в том, что он может генерировать реактивный электрофил, не конкурируя с желаемым продуктом.

Недавние разработки, использующие проксимальные функциональные группы, сделали возможным конденсацию гидразона.[20] работать на 20 М−1s−1 при нейтральном pH, в то время как была обнаружена конденсация оксима, которая протекает при 500-10000 M−1s−1 при нейтральном pH без добавления катализаторов.[21][22]
Лигирование Штаудингера азидами
В Лигирование по Штаудингеру азидов и фосфин широко используется в области химической биологии. Потому что он может образовывать стабильную амидная связь в живых клетках и животных он применялся для модификации клеточная мембрана, in vivo визуализация, и другие исследования биоконъюгации.[23][24][25][26]
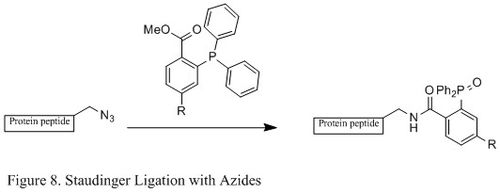
В отличие от классической реакции Штаудингера, лигирование Штаудингера представляет собой реакция второго порядка в котором лимитирующим этапом является образование фосфазид (конкретный механизм реакции показан на Рисунок 9). В трифенилфосфин сначала реагирует с азидом с образованием азалида через четырехчленное кольцо переходное состояние, а затем внутримолекулярная реакция приводит к иминофосфоран промежуточное соединение, которое затем будет давать амидную связь при гидролизе.[27]

Циклизация азидов по Хьюсгену
Катализируемая медью циклизация азидов по Хьюисгену
Азиды стали популярной мишенью для хемоселективной модификации белков, поскольку они имеют небольшой размер и благоприятные термодинамический реакционный потенциал. Одной из таких реакций азидов является реакция [3 + 2] циклоприсоединения с алкин, но реакция требует высокой температуры и часто дает смеси региоизомеры.

Улучшенная реакция, разработанная химиком Карл Барри Шарплесс включает катализатор меди (I), который связывает азид с концевым алкином, что дает только 1,4-замещенные 1,2,3-триазолы с высокими выходами (показано ниже в Рисунок 11). Механическое исследование предполагает ступенчатую реакцию.[8] Cu (I) первые пары с ацетилены, а затем он реагирует с азидом с образованием шестичленного промежуточного соединения. Процесс очень устойчивый, так как он протекает при pH от 4 до 12, а сульфат меди (II) часто используется в качестве катализатора в присутствии Восстановитель.[8]

Штамм способствовал циклизации азидов по Хьюисгену
Хотя лигирование по Штаудингеру является подходящей биоконъюгацией в живых клетках без большой токсичности, чувствительность фосфина к окислению воздухом и его низкая растворимость в воде значительно снижают его эффективность. Азид-алкиновое сочетание, катализируемое медью (I), имеет приемлемую скорость реакции и эффективность в физиологических условиях, но медь представляет собой значительную токсичность и иногда нарушает функции белка в живых клетках. В 2004 г. химик Кэролайн Р. Бертоцци лаборатория разработала безметалловое [3 + 2] циклоприсоединение с использованием напряженного циклооктина и азида. Циклооктин, который является наименьшим стабильным циклоалкином, может соединяться с азидом посредством [3 + 2] циклоприсоединения, что приводит к двум региоизомерным триазолам (Рисунок 12).[6] Реакция легко протекает при комнатная температура и поэтому может быть использован для эффективной модификации живых клеток без отрицательных эффектов. Также сообщалось, что установка фтор заместители в циклическом алкине могут значительно ускорить скорость реакции.[2][28]

Примеры прикладных методов биоконъюгирования
Факторы роста
Сообщалось о биоконъюгации TGF-β с наночастицами оксида железа и его активации посредством магнитной гипертермии in vitro.[29] Это было сделано с использованием 1- (3-диметиламинопропил) этилкарбодиимида в сочетании с N-гидроксисукцинимидом с образованием первичных амидных связей со свободными первичными аминами на факторе роста. Углеродные нанотрубки успешно используются в сочетании с биоконъюгированием для связывания TGF-β с последующей активацией светом ближнего инфракрасного диапазона.[30] Обычно эти реакции включают использование сшивающего агента, но некоторые из них добавляют молекулярное пространство между представляющим интерес соединением и основным материалом и, в свою очередь, вызывают более высокие степени неспецифического связывания и нежелательной реакционной способности.[31]
Смотрите также
- Иммунофлуоресценция
- Биомолекулярная инженерия
- Биотинилирование
- SpyTag / SpyCatcher
- Неестественные аминокислоты
- Биоконъюгат Химия журнал
использованная литература
- ^ а б c d е ж г Stephanopoulos, N .; Фрэнсис, М. Б. (2011). «Выбор эффективной стратегии биоконъюгации белков». Природа Химическая Биология. 7 (12): 876–884. Дои:10.1038 / nchembio.720. PMID 22086289.
- ^ а б c Tilley, S.D .; Джоши, Н. С .; Фрэнсис, М. Б. (2008). «Белки: химия и химическая активность». Энциклопедия химической биологии Wiley. Дои:10.1002 / 9780470048672.wecb493. ISBN 978-0470048672.
- ^ а б c d е Francis, M. B .; Каррико, И. С. (2010). «Новые рубежи в биоконъюгации белков». Современное мнение в области химической биологии. 14 (6): 771–773. Дои:10.1016 / j.cbpa.2010.11.006. PMID 21112236.
- ^ а б Kalia, J .; Рейнс, Р. Т. (2010). «Достижения в биоконъюгации». Современная органическая химия. 14 (2): 138–147. Дои:10.2174/138527210790069839. ЧВК 2901115. PMID 20622973.
- ^ а б Каррико, И. С .; Carlson, B.L .; Бертоцци, К. Р. (2007). «Введение в белки генетически кодируемых альдегидов». Природа Химическая Биология. 3 (6): 321–322. Дои:10.1038 / nchembio878. PMID 17450134.
- ^ а б Agard, N.J .; Прешер, Дж. А .; Бертоцци, К. Р. (2004). «Штамм-промотируемое 3 + 2] азид-алкиновое циклоприсоединение для ковалентной модификации биомолекул в живых системах». Журнал Американского химического общества. 126 (46): 15046–15047. Дои:10.1021 / ja044996f. PMID 15547999.
- ^ Kolb, H.C .; Finn, M. G .; Шарплесс, К. Б. (2001). «Щелкните Химия: Разнообразная химическая функция из нескольких хороших реакций». Angewandte Chemie International Edition. 40 (11): 2004–2021. Дои:10.1002 / 1521-3773 (20010601) 40:11 <2004 :: AID-ANIE2004> 3.0.CO; 2-5. PMID 11433435.
- ^ а б c Ростовцев, Всеволод В .; Грин, Люк Дж .; Фокин, Валерий В .; Шарплесс, К. Барри (2002). «Поэтапный процесс циклоприсоединения по Хьюисгену: региоселективное« лигирование »азидов и концевых алкинов, катализируемое медью (I)». Angewandte Chemie International Edition. 41 (14): 2596–2599. Дои:10.1002 / 1521-3773 (20020715) 41:14 <2596 :: AID-ANIE2596> 3.0.CO; 2-4. ISSN 1433-7851. PMID 12203546.
- ^ Кониев, О .; Вагнер, А. (2015). «Разработки и последние достижения в области реакций образования селективных связей между эндогенными аминокислотами для биоконъюгирования». Chem. Soc. Rev. 44 (15): 5495–5551. Дои:10.1039 / C5CS00048C. PMID 26000775.
- ^ Thordarson, P .; Le Droumaguet, B .; Велония, К. (2006). «Четко определенные конъюгаты белок-полимер - синтез и потенциальные применения». Прикладная микробиология и биотехнология. 73 (2): 243–254. Дои:10.1007 / s00253-006-0574-4. PMID 17061132. S2CID 23657616.
- ^ Yang, W .; Тордарсон, П. (2007). «Углеродные нанотрубки для биологических и биомедицинских приложений». Нанотехнологии. 18 (41): 412001. Bibcode:2007Нанот..18О2001Г. Дои:10.1088/0957-4484/18/41/412001.
- ^ Гербер, HP; Senter, PD; Grewal, IS (2009). «Конъюгаты антител и лекарств, нацеленные на сосудистую сеть опухоли: текущие и будущие разработки». MAbs. 1 (3): 247–53. Дои:10.4161 / мабс.1.3.8515. ЧВК 2726597. PMID 20069754. Архивировано из оригинал 2 февраля 2014 г.
- ^ Довгань, И .; Ursuegui, S .; Erb, S .; Michel, C .; Колодыч, С .; Cianférani, S .; Вагнер, А. (2017). «Ацилфториды: быстрое, эффективное и универсальное конъюгация белков на основе лизина с помощью стратегии Plug-and-Play». Биоконъюгат Chem. 28 (5): 1452–1457. Дои:10.1021 / acs.bioconjchem.7b00141. PMID 28443656.
- ^ Fodje, M. N .; Аль-Карадаги, С. (2002). «Возникновение, конформационные особенности и аминокислотные склонности для π-спирали». Protein Eng. 15 (5): 353–358. Дои:10.1093 / белок / 15.5.353. PMID 12034854.
- ^ Shiu, H.-Y .; Chan, T.-C .; Ho, C.-M .; Lin, Y .; Вонг, М.-К .; Че, Ч.-М. (2009). «Электронно-дефицитные алкины как расщепляемые реагенты для модификации цистеин-содержащих пептидов в водной среде». Chem. Евро. J. 15 (15): 3839–3850. Дои:10.1002 / chem.200800669. PMID 19229937.
- ^ Кониев, О .; Leriche, G .; Nothisen, M .; Remy, J.-S .; Strub, J.-M .; Schaeffer-Reiss, C .; Dorsselaer, A .; Baati, R .; Вагнер, А. (2014). «Селективное необратимое химическое мечение цистеина с 3-арилпропиолонитрилами». Биоконъюгат Chem. 25 (2): 202–206. Дои:10.1021 / bc400469d. PMID 24410136.
- ^ Ban, H .; Nagano, M .; Гаврилюк, Дж .; Барбас, К.Ф. (2015). «Легкие и стабильные связи через тирозин: стратегии биоконъюгации с реакцией тирозин-щелчок». Биоконъюгат Chem. 4 (24): 520–532. Дои:10.1021 / bc300665t. ЧВК 3658467. PMID 23534985.
- ^ Joshi, N.S .; Whitaker, L.R .; Фрэнсис, М. (2004). «Трехкомпонентная реакция типа Манниха для селективного биоконъюгирования тирозина». Варенье. Chem. Soc. 126 (49): 15942–15943. Дои:10.1021 / ja0439017. PMID 15584710.
- ^ а б Дирксен, А .; Hackeng, T. M .; Доусон, П. Э. (2006). «Нуклеофильный катализ лигирования оксима». Angewandte Chemie International Edition. 45 (45): 7581–4. Дои:10.1002 / anie.200602877. PMID 17051631.
- ^ Кул, Эрик; Пак, До-Хён; Крисалли, Пит (2013). «Быстрые гидразоновые реагенты: электронные и кислотно-щелочные эффекты сильно влияют на скорость при биологическом pH». Журнал Американского химического общества. 135 (47): 17663–17666. Дои:10.1021 / ja407407h. ЧВК 3874453. PMID 24224646.
- ^ Шмидт, Паскаль; Чжоу, Линна; Тишинов, Кирилл; Циммерманн, Каспар; Джиллингем, Деннис (2014). «Диальдегиды приводят к исключительно быстрым биоконъюгациям при нейтральном pH благодаря циклическому промежуточному соединению». Angewandte Chemie International Edition. 53 (41): 10928–10931. Дои:10.1002 / anie.201406132. PMID 25164607.
- ^ Шмидт, Паскаль; Стресс, Седрик; Джиллингем, Деннис (2015). «Бороновые кислоты способствуют быстрой конденсации оксима при нейтральном pH» (PDF). Химическая наука. 6 (6): 3329–3333. Дои:10.1039 / C5SC00921A. ЧВК 5656983. PMID 29142692.
- ^ Lemieux, G.A .; De Graffenrie, C.L .; Бертоцци, К. Р. (2003). «Флуорогенный краситель, активированный лигированием Штаудингера». Журнал Американского химического общества. 125 (16): 4708–4709. Дои:10.1021 / ja029013y. PMID 12696879.
- ^ Laughlin, S.T .; Baskin, J.M .; Amacher, S.L .; Бертоцци, К. Р. (2008). «Визуализация in vivo связанных с мембраной гликанов у рыбок данио». Наука. 320 (5876): 664–667. Bibcode:2008Sci ... 320..664L. Дои:10.1126 / science.1155106. ЧВК 2701225. PMID 18451302.
- ^ Saxon, E .; Бертоцци, К. Р. (2000). «Инженерия клеточной поверхности с помощью модифицированной реакции Штаудингера». Наука. 287 (5460): 2007–2010. Bibcode:2000Sci ... 287. 2007S. Дои:10.1126 / science.287.5460.2007. PMID 10720325. S2CID 19720277.
- ^ Прешер, Дж. А .; Dube, D. H .; Бертоцци, К. Р. (2004). «Химическое ремоделирование клеточных поверхностей у живых животных». Природа. 430 (7002): 873–877. Bibcode:2004Натура 430..873П. Дои:10.1038 / природа02791. PMID 15318217. S2CID 4371934.
- ^ Lin, F. L .; Hoyt, H.M .; Van Halbeek, H .; Bergman, R.G .; Бертоцци, К. Р. (2005). «Механистическое исследование перевязки Штаудингера». Журнал Американского химического общества. 127 (8): 2686–2695. Дои:10.1021 / ja044461m. PMID 15725026.
- ^ Chang, P. V .; Прешер, Дж. А .; Sletten, E.M .; Baskin, J.M .; Миллер, И. А .; Agard, N.J .; Lo, A .; Бертоцци, К. Р. (2010). «Щелочная химия без меди у живых животных». Труды Национальной академии наук. 107 (5): 1821–1826. Bibcode:2010PNAS..107.1821C. Дои:10.1073 / pnas.0911116107. ЧВК 2836626. PMID 20080615.
- ^ Ази, О; Гринберг, ZF; Батич, КД; Добсон, JP (2019). «Конъюгация карбодиимида латентного трансформирующего фактора роста β1 в суперпарамагнитные наночастицы оксида железа для удаленной активации». Int J Mol Sci. 20 (13): 3190. Дои:10.3390 / ijms20133190. ЧВК 6651417. PMID 31261853.
- ^ Lin, L .; Liu, L .; Чжао, Б .; и другие. (2015). «Оптическая активация передачи сигналов TGF-β с помощью углеродных нанотрубок ближним инфракрасным светом». Природа Нанотехнологии. 10 (5): 465–471. Bibcode:2015НатНа..10..465Л. Дои:10.1038 / nnano.2015.28. PMID 25775150.
- ^ Lalli, E .; Sarti, G .; Бой, К. (2018). «Влияние спейсерного плеча на неспецифическое связывание в мембранной аффинной хроматографии». MRS Communications. 8 (1): 65–70. Дои:10.1557 / mrc.2018.4.
