Нейроиммунная система - Википедия - Neuroimmune system
| Нейроиммунная система | |
|---|---|
 На этой диаграмме изображены нейроиммунные механизмы, которые опосредуют индуцированное метамфетамином нейродегенерация в человеческом мозгу.[1] В NF-κB -опосредованный нейроиммунный ответ на употребление метамфетамина, который приводит к повышенной проницаемости гематоэнцефалический барьер возникает через его связывание и активацию рецепторы сигма-1, увеличение производства активные формы кислорода (ROS), активные формы азота (RNS) и молекулы молекулярной структуры, связанные с повреждениями (DAMPs) нарушение регуляции переносчики глутамата (конкретно, EAAT1 и EAAT2 ) и метаболизм глюкозы, и чрезмерный приток кальция в глиальные клетки и дофамин нейроны.[1][2][3] | |
| Подробности | |
| Система | Нейроиммунный |
| Идентификаторы | |
| MeSH | D015213 |
| Анатомическая терминология | |
В нейроиммунная система это система структур и процессов, включающая биохимический и электрофизиологический взаимодействие между нервная система и иммунная система которые защищают нейроны из патогены. Он служит для защиты нейронов от болезней, поддерживая избирательно проницаемые барьеры (например, гематоэнцефалический барьер и барьер между кровью и спинномозговой жидкостью ), посредничество нейровоспаление и лечение раны в поврежденных нейронах и мобилизации защиты хозяина от патогенов.[2][4][5]
Нейроиммунная система и периферическая иммунная система структурно различаются. В отличие от периферической системы, нейроиммунная система состоит в основном из глиальные клетки;[1][5] среди всех гемопоэтические клетки иммунной системы, только тучные клетки обычно присутствуют в нейроиммунной системе.[6] Однако во время нейроиммунного ответа определенные периферические иммунные клетки способны преодолевать различные барьеры кровь или жидкость-мозг, чтобы реагировать на патогены, проникшие в мозг.[2] Например, есть свидетельства того, что после травмы макрофаги и Т-клетки иммунной системы мигрируют в спинной мозг.[7] Производство иммунных клеток система комплемента также были задокументированы как создаваемые непосредственно в центральной нервной системе.[8]
Структура
Эта секция нуждается в расширении. Вы можете помочь добавляя к этому. (Октябрь 2016) |
Ключевые клеточные компоненты нейроиммунной системы: глиальные клетки, включая астроциты, микроглия, и олигодендроциты.[1][2][5] в отличие от других гемопоэтические клетки периферической иммунной системы, тучные клетки естественным образом возникают в головном мозге, где они опосредуют взаимодействия между кишечными микробами, иммунной системой и центральной нервной системой как часть ось микробиота-кишечник-мозг.[6]
G-белковые рецепторы которые присутствуют в обоих ЦНС и типы иммунных клеток, которые отвечают за нейроиммунный сигнальный процесс, включают:[4]
- Хемокин рецепторы: CXCR4
- Каннабиноидные рецепторы: CB1, CB2, GPR55
- Следы рецепторов, связанных с амином: TAAR1
- μ-опиоидные рецепторы - все подтипы
Клеточная физиология
Нейроиммунная система и ее изучение включают понимание иммунной и неврологической систем и перекрестного регулирующего воздействия их функций.[9] Цитокины регулируют иммунные ответы, возможно, за счет активации оси гипоталамус-гипофиз-надпочечники (HPA).[требуется медицинская цитата ] Цитокины также участвуют в координации между нервной и иммунной системами.[10] Случаи связывания цитокинов с нервными рецепторами были зарегистрированы между высвобождающими цитокины иммунными клетками. ИЛ-1 β и нервный рецептор ИЛ-1Р.[10] Это связывание приводит к электрическому импульсу, который вызывает ощущение боли.[10] Все больше данных свидетельствует о том, что аутоиммунные Т-клетки участвуют в нейрогенезе. Исследования показали, что во время адаптивного ответа иммунной системы нейрогенез гиппокампа усиливается, и, наоборот, аутоиммунные Т-клетки и микроглия важны для нейрогенеза (и, следовательно, памяти и обучения) у здоровых взрослых.[11]
Нейроиммунная система использует взаимодополняющие процессы обоих сенсорные нейроны и иммунные клетки для обнаружения ядовитых или вредных раздражителей и реагирования на них.[10] Например, вторгшиеся бактерии могут одновременно активировать инфламмасомы, который процесс интерлейкины (ИЛ-1 β ), и деполяризуют сенсорные нейроны за счет секреции гемолизины.[10][12] Гемолизины создают поры, вызывая деполяризующее высвобождение ионов калия изнутри эукариотической клетки и приток ионов кальция.[10] Вместе это приводит к потенциалу действия в сенсорных нейронах и активации инфламмасом.[10]
Травмы и некроз также вызывают нейроиммунный ответ. Выпуск аденозинтрифосфат (АТФ) из поврежденных клеток связывается и активирует оба P2X7 рецепторы на макрофаги иммунной системы, и P2X3 рецепторы ноцицепторы нервной системы.[10] Это вызывает комбинированный ответ как результирующего потенциала действия из-за деполяризации, создаваемой притоком ионов кальция и калия, так и активации инфламмасом.[10] Создаваемый потенциал действия также отвечает за ощущение боли, и иммунная система вырабатывает IL-1β в результате связывания рецептора АТФ P2X7.[10]
Хотя воспаление обычно рассматривается как иммунный ответ, существует согласованность нервных процессов, связанных с воспалительный процесс иммунной системы. После травмы или инфекции возникает каскад воспалительных реакций, таких как секреция циоткины и хемокины эта пара с секрецией нейропептиды (Такие как вещество P ) и нейротрансмиттеры (такие как серотонин ).[7][10][12] Вместе этот сопряженный нейроиммунный ответ оказывает усиливающее действие на воспаление.[10]
Нейроиммунные ответы
Взаимодействие нейрон-глиальных клеток
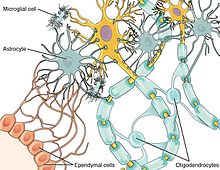
Нейроны и глиальные клетки работают вместе, чтобы бороться с вторжением патогенов и травмами. Хемокины играют важную роль в качестве посредника между нейрон-глиальными клетками, поскольку оба типа клеток экспрессируют хемокиновые рецепторы.[7] Например, хемокин фракталкин был вовлечен в общение между микроглия и ганглий дорзального корня (DRG) нейроны спинного мозга.[13] Фракталкин был связан с повышенной чувствительностью к боли при инъекции. in vivo, и было обнаружено, что он активирует молекулы, опосредующие воспаление.[13] Глиальные клетки могут эффективно распознавать патогены как в центральной нервной системе, так и в периферических тканях.[14] Когда глиальные клетки распознают чужеродные патогены с помощью передачи сигналов цитокинов и хемокинов, они могут передавать эту информацию в ЦНС.[14] Результат - усиление депрессивных симптомов.[14] Однако хроническая активация глиальных клеток приводит к нейродегенерация и нейровоспаление.[14]
Клетки микроглии являются одними из самых известных типов глиальных клеток головного мозга. Одна из их основных функций - фагоцитозирование клеточный мусор после нейронального апоптоз.[14] После апоптоза мертвые нейроны выделяют химические сигналы, которые связываются с микроглиальными клетками и заставляют их поглощать вредный мусор из окружающей нервной ткани.[14] Микроглия и система комплемента также связаны с синаптическая обрезка поскольку их секреция цитокинов, факторов роста и других дополнительных компонентов способствует удалению устаревших синапсов.[14]
Астроциты - это еще один тип глиальных клеток, которые, помимо других функций, модулируют проникновение иммунных клеток в ЦНС через гематоэнцефалический барьер (BBB).[14] Астроциты также выделяют различные цитокины и нейротрофины которые позволяют иммунным клеткам проникать в ЦНС; эти рекрутированные иммунные клетки нацелены как на патогены, так и на поврежденную нервную ткань.[14]
Рефлексы
Абстинентный рефлекс

В абстинентный рефлекс это рефлекс, защищающий организм от вредных раздражителей.[12] Этот рефлекс возникает при активации вредных раздражителей. ноцицепторы которые посылают потенциал действия к нервы в позвоночнике, которые затем иннервируют эффекторные мышцы и вызывают внезапный рывок, уводящий организм от опасных раздражителей.[10] Рефлекс отмены затрагивает как нервную, так и иммунную системы.[10] Когда потенциал действия возвращается по сети спинномозговых нервов, другой импульс проходит к периферическим сенсорным нейронам, которые секретируют аминокислоты и нейропептиды, подобные пептид, связанный с геном кальцитонина (CGRP) и Вещество P.[10][12] Эти химические вещества действуют, увеличивая покраснение, отек поврежденных тканей и прикрепляя иммунные клетки к эндотелиальный ткани, тем самым увеличивая проницаемость иммунных клеток через капилляры.[10][12]
Рефлекторный ответ на патогены и токсины
Нейроиммунные взаимодействия также возникают при патогены, аллергены, или токсины проникают в организм.[10] В блуждающий нерв соединяется с кишечником и дыхательными путями и вызывает нервные импульсы в мозговой ствол в ответ на обнаружение токсинов и патогенов.[10] Этот электрический импульс, идущий от ствола головного мозга к слизистая оболочка клетки и стимулирует выделение слизи; этот импульс также может вызвать выброс токсина из-за мышечных сокращений, вызывающих рвоту или диарею.[10]
Рефлекторный ответ на паразитов
Нейроиммунная система участвует в рефлексах, связанных с паразитарным вторжением хозяев. Ноцицепторы также связаны с рефлексами организма на патогены, поскольку они находятся в стратегически важных местах, таких как дыхательные пути и ткани кишечника, и вызывают сокращения мышц, вызывающие расчесывание, рвоту и кашель.[10] Все эти рефлексы предназначены для изгнания патогенов из организма. Например, расчесывание вызывается зудящими генами, которые стимулируют ноцицепторы на эпидермальных тканях.[10] Эти пруритогены, как гистамин, также заставляют другие иммунные клетки секретировать дополнительные пруритогены, чтобы вызвать больший зуд, чтобы физически удалить паразитических захватчиков.[10] Что касается кишечных и бронхиальных паразитов, то рвота, кашель и диарея также могут быть вызваны стимуляцией ноцицепторов в инфицированных тканях и нервными импульсами, исходящими от мозговой ствол которые иннервируют соответствующие гладкие мышцы.[10]
Эозинофилы в ответ на капсаицин, может вызвать дополнительную сенсибилизацию к молекуле.[15] Пациенты с хроническим кашель также имеют повышенный кашлевой рефлекс на патогенные микроорганизмы, даже если возбудитель был изгнан.[15] В обоих случаях выпуск эозинофилы и другие иммунные молекулы вызывают гиперчувствительность сенсорных нейронов в дыхательных путях бронхов, что вызывает усиление симптомов.[10][15] Также сообщалось, что повышенная секреция нейротрофинов иммунными клетками в ответ на загрязнители и раздражители может реструктурировать периферическую сеть нервов в дыхательных путях, чтобы обеспечить более примированное состояние сенсорных нейронов.[10]
Клиническое значение
Было продемонстрировано, что длительный психологический стресс может быть связан с повышенным риском заражения респираторными вирусными инфекциями. Исследования на животных показывают, что психологический стресс повышает уровень глюкокортикоидов и, в конечном итоге, повышает восприимчивость к стрептококковым кожным инфекциям.[16]
Нейроиммунная система играет роль в Болезнь Альцгеймера. В частности, микроглия может защищать, стимулируя фагоцитоз и удаление амилоид-β (Aβ) отложения, но также становятся дисфункциональными по мере прогрессирования болезни, производя нейротоксины, прекращая очищать отложения Aβ и производя цитокины которые дополнительно способствуют отложению Aβ.[17] Было показано, что при болезни Альцгеймера амилоид-β напрямую активирует микроглию и другие моноциты с образованием нейротоксины.[18]
Астроциты также участвуют в рассеянный склероз (РС). Астроциты отвечают за демиелинизация и уничтожение олигодендроциты что связано с заболеванием.[14] Этот демиелинизирующий эффект является результатом секреции цитокинов и матричные металлопротеиназы (ММП) из активированных клеток астроцитов на соседние нейроны.[14] Астроциты, которые остаются в активированном состоянии, образуют глиальные рубцы, которые также предотвращают повторную миелинизацию нейронов, поскольку они являются физическим препятствием для клетки-предшественники олигодендроцитов (OPC).[19]
Нейроиммунная система также участвует в астма и хронический кашель, поскольку оба являются результатом сверхчувствительного состояния сенсорных нейронов из-за высвобождения иммунных молекул и механизмов положительной обратной связи.[15]
Доклинические и клинические исследования показали, что клеточные (микроглия / макрофаги, лейкоциты, астроциты, тучные клетки и т. Д.) И молекулярные нейроиммунные реакции способствуют вторичному повреждению головного мозга после внутримозгового кровоизлияния.[20][21]
Смотрите также
Рекомендации
- ^ а б c d Бердсли П.М., Хаузер К.Ф. (2014). «Глиальные модуляторы как потенциальные методы лечения злоупотребления психостимуляторами». Новые цели и методы лечения злоупотребления психостимуляторами. Adv. Pharmacol. Успехи фармакологии. 69. С. 1–69. Дои:10.1016 / B978-0-12-420118-7.00001-9. ISBN 9780124201187. ЧВК 4103010. PMID 24484974.
Глия (включая астроциты, микроглию и олигодендроциты), которые составляют большинство клеток головного мозга, имеют многие из тех же рецепторов, что и нейроны, секретируют нейротрансмиттеры, нейротрофические и нейровоспалительные факторы, контролируют клиренс нейротрансмиттеров из синаптических щелей и непосредственно участвуют в ней. в синаптической пластичности. Несмотря на их распространенность и спектр функций, понимание их потенциальной общей важности было труднодостижимым с момента их идентификации в середине 1800-х годов, и лишь относительно недавно они завоевали должное уважение. Такое развитие признательности питалось растущим осознанием того, что наркотические вещества, включая психостимуляторы, влияют на глиальную активность, а глиальная активность, в свою очередь, модулирует эффекты психостимуляторов.
- ^ а б c d Лофтис Дж. М., Яновский А. (2014). «Нейроиммунные основы токсичности метамфетамина». Нейроиммунные сигналы при лекарствах и зависимостях. Int. Преподобный Neurobiol. Международный обзор нейробиологии. 118. С. 165–197. Дои:10.1016 / B978-0-12-801284-0.00007-5. ISBN 9780128012840. ЧВК 4418472. PMID 25175865.
В совокупности эти патологические процессы способствуют нейротоксичности (например, повышенная проницаемость ГЭБ, воспаление, дегенерация нейронов, гибель клеток) и нейропсихиатрическим нарушениям (например, когнитивным дефицитам, расстройствам настроения).
"Рисунок 7.1: Нейроиммунные механизмы токсичности ЦНС, вызванной метамфетамином " - ^ Каушал Н., Мацумото Р.Р. (март 2011 г.). «Роль сигма-рецепторов в нейротоксичности, вызванной метамфетамином». Курр нейрофармакол. 9 (1): 54–57. Дои:10.2174/157015911795016930. ЧВК 3137201. PMID 21886562.
- ^ а б Роджерс TJ (2012). «Молекулярная основа передачи сигналов нейроиммунных рецепторов». J Neuroimmune Pharmacol. 7 (4): 722–4. Дои:10.1007 / s11481-012-9398-4. ЧВК 4011130. PMID 22935971.
- ^ а б c Gimsa U, Mitchison NA, Brunner-Weinzierl MC (2013). «Иммунная привилегия как внутреннее свойство ЦНС: астроциты защищают ЦНС от нейровоспаления, опосредованного Т-клетками». Медиаторы воспаления. 2013: 1–11. Дои:10.1155/2013/320519. ЧВК 3760105. PMID 24023412.
Астроциты выполняют множество функций в центральной нервной системе (ЦНС). ... они ответственны за формирование гематоэнцефалического барьера (ГЭБ) и образуют ограничители глии. Здесь мы рассматриваем их вклад в нейроиммунные взаимодействия и, в частности, на те, которые индуцируются инвазией активированных Т-клеток. ... В центральной нервной системе (ЦНС) астроциты являются наиболее многочисленными клетками.
- ^ а б Polyzoidis S, Koletsa T, Panagiotidou S, Ashkan K, Theoharides TC (2015). «Тучные клетки при менингиомах и воспалении головного мозга». J нейровоспаление. 12 (1): 170. Дои:10.1186 / s12974-015-0388-3. ЧВК 4573939. PMID 26377554.
MC происходят от предшественника костного мозга и впоследствии развивают различные фенотипические характеристики локально в тканях. Их спектр функций широк и включает участие в аллергических реакциях, врожденном и адаптивном иммунитете, воспалении и аутоиммунитете [34]. В головном мозге человека MC могут располагаться в различных областях, таких как гипофиз, эпифиз, постремная зона, сосудистое сплетение, таламус, гипоталамус и срединное возвышение [35]. В мозговых оболочках они обнаруживаются в слое твердой мозговой оболочки вместе с сосудами и окончаниями ноцицепторов менингеальных сосудов [36]. MC имеют отличительную особенность по сравнению с другими гематопоэтическими клетками в том, что они находятся в головном мозге [37]. MC содержат множество гранул и секретируют множество предварительно сохраненных медиаторов, таких как кортикотропин-рилизинг-гормон (CRH), нейротензин (NT), вещество P (SP), триптаза, химаза, вазоактивный кишечный пептид (VIP), фактор роста эндотелия сосудов (VEGF) , TNF, простагландины, лейкотриены и разновидности хемокинов и цитокинов, некоторые из которых, как известно, нарушают целостность гематоэнцефалического барьера (BBB) [38-40].
Ключевая роль MC в воспалении [34] и нарушении ГЭБ [41–43] указывает на важность областей для новых исследований в области терапии. Все больше данных также указывает на то, что MC участвуют в нейровоспалении напрямую [44–46] и через стимуляцию микроглии [47], внося свой вклад в патогенез таких состояний, как головные боли [48] аутизм [49] и синдром хронической усталости [50]. Фактически, недавний обзор показал, что периферические воспалительные стимулы могут вызывать активацию микроглии [51], таким образом, возможно, вовлекая MC вне мозга. - ^ а б c Цзи, Ру-Ронг; Сюй, Чжэнь-Чжун; Гао, Юн-Цзин (2014). «Новые цели в хронической боли, вызванной нейровоспалением». Обзоры природы Drug Discovery. 13 (7): 533–548. Дои:10.1038 / nrd4334. ЧВК 4228377. PMID 24948120.
- ^ Стефан, Александр Х .; Баррес, Бен А .; Стивенс, Бет (01.01.2012). «Система комплемента: неожиданная роль в синаптическом сокращении во время развития и болезни». Ежегодный обзор нейробиологии. 35 (1): 369–389. Дои:10.1146 / annurev-neuro-061010-113810. PMID 22715882.
- ^ Брэди, Скотт Т .; Сигел, Джордж Дж. (01.01.2012). Основы нейрохимии: принципы молекулярной, клеточной и медицинской нейробиологии. Академическая пресса. ISBN 9780123749475.
- ^ а б c d е ж грамм час я j k л м п о п q р s т ты v ш Икс у Талбот, Себастьян; Фостер, Симми; Вульф, Клиффорд (22 февраля 2016 г.). «Нейроиммунная физиология и патология». Ежегодный обзор нейробиологии. 34: 421–47. Дои:10.1146 / аннурьев-иммунол-041015-055340. PMID 26907213.
- ^ Зив И., Рон Н., Бутовский О., Ланда Г., Судаи Е., Гринберг Н., Коэн Н., Кипнис Дж., Шварц М. (2006). «Иммунные клетки способствуют поддержанию нейрогенеза и способности к пространственному обучению во взрослом возрасте». Nat. Неврологи. 9 (2): 268–75. Дои:10.1038 / nn1629. PMID 16415867. S2CID 205430936.
- ^ а б c d е МакМахон, Стивен; Ла Русса, Федерика; Беннетт, Дэвид (19 июня 2015 г.). «Перекрестные помехи между ноцицептивной и иммунной системами в защите хозяина и болезни». Обзоры природы Неврология. 16 (7): 389–402. Дои:10.1038 / nrn3946. PMID 26087680. S2CID 22294761.
- ^ а б Миллер, Ричард; Хосунг, Юнг; Бхангу, Соня; Флетчер, Уайт (2009). Сенсорные нервы. Гейдельберг, Германия: Springer. С. 417–449. ISBN 978-3-540-79090-7.
- ^ а б c d е ж грамм час я j k Тиан, Ли; Ма, Ли; Каарела, Тийна; Ли, Жилин (2 июля 2012 г.). «Нейроиммунные перекрестные помехи в центральной нервной системе и их значение для неврологических заболеваний». Журнал нейровоспаления. 9: 155. Дои:10.1186/1742-2094-9-155. ЧВК 3410819. PMID 22747919.
- ^ а б c d Чунг, Киан (октябрь 2014 г.). «Подход к хроническому кашлю: нейропатическая основа синдрома гиперчувствительности при кашле». Журнал торакальных болезней. 6 (Дополнение 7): S699–707. Дои:10.3978 / j.issn.2072-1439.2014.08.41. ЧВК 4222934. PMID 25383203.
- ^ Кавли, Трупти; Он, Фанглиан; Тан, Ман-Ва (01.01.2010). «Чтобы бороться с инфекциями, нужны нервы: выводы о нейроиммунных взаимодействиях от C. elegans». Модели и механизмы заболеваний. 3 (11–12): 721–731. Дои:10.1242 / дмм.003871. ISSN 1754-8403. ЧВК 2965399. PMID 20829562.
- ^ Farfara, D .; Лифшиц, В .; Френкель, Д. (2008). «Нейропротекторные и нейротоксические свойства глиальных клеток в патогенезе болезни Альцгеймера». Журнал клеточной и молекулярной медицины. 12 (3): 762–780. Дои:10.1111 / j.1582-4934.2008.00314.x. ISSN 1582-1838. ЧВК 4401126. PMID 18363841.
- ^ Хикман С.Е., Эль-Хури Дж. (2013). «Нейроиммунная система при болезни Альцгеймера: стакан наполовину полон». Дж. Альцгеймерс Дис. 33 Приложение 1: S295–302. Дои:10.3233 / JAD-2012-129027. PMID 22751176.
- ^ Наир, Аджи; Фредерик, Терра; Миллер, Стивен (сентябрь 2008 г.). «Астроциты при рассеянном склерозе: продукт окружающей среды». Клеточные и молекулярные науки о жизни. 65 (17): 2702–20. Дои:10.1007 / s00018-008-8059-5. ЧВК 2858316. PMID 18516496.
- ^ Ren H, Han R, Chen X, Liu X, Wan J, Wang L, Yang X, Wang J (май 2020 г.). «Возможные терапевтические цели для воспаления, связанного с внутримозговым кровоизлиянием: обновленная информация». J Cereb Blood Flow Metab. 40 (9): 1752–1768. Дои:10.1177 / 0271678X20923551. ЧВК 7446569. PMID 32423330.
- ^ Zhu H, Wang Z, Yu J, Yang X, He F, Liu Z, Che F, Chen X, Ren H, Hong M, Wang J (март 2019). «Роль и механизмы цитокинов при вторичном повреждении головного мозга после внутримозгового кровоизлияния». Прог. Нейробиол. 178: 101610. Дои:10.1016 / j.pneurobio.2019.03.003. PMID 30923023. S2CID 85495400.
дальнейшее чтение
- Икезу, Цунейя; Гендельман, Ховард Э. (21 марта 2008 г.). Нейроиммунная фармакология. Springer Science & Business Media. ISBN 9780387725734.

