Protectin D1 - Википедия - Protectin D1
| Имена | |
|---|---|
| Название ИЮПАК (4Z, 7Z, 10R, 11E, 13E, 15Z, 17S, 19Z) -10,17-дигидроксидокоза-4,7,11,13,15,19-гексаеновая кислота | |
| Другие имена 10R, 17S-дигидроксидокоса-4Z, 7Z, 11E, 13E, 15Z, 19Z-гексаеноат; 10R, 17S-дигидроксидокоза-4Z, 7Z, 11E, 13E, 15Z, 19Z-гексаеновая кислота; Нейропротектин D1 | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ChemSpider | |
PubChem CID | |
| |
| |
| Характеристики | |
| C22ЧАС32О4 | |
| Молярная масса | 360,4871 г / моль |
| Плотность | 1,049 г / см3 |
| Точка кипения | 559,379 ° С (1038,882 ° F, 832,529 К) |
| 0.0069 | |
| бревно п | 4.95 |
| Кислотность (пKа) | 4.82 |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Протектин D1 также известный как нейропротектин D1 (когда он действует в нервной системе) и чаще всего сокращенно PD1 или NPD1 является членом класса специализированные прорешающие посредники. Как и другие представители этого класса метаболитов полиненасыщенных жирных кислот, он обладает сильным противовоспалительным, антиапоптотическим и нейропротекторным действием. PD1 - это алифатический ациклический алкен 22 атома углерода с двумя гидроксильными группами в положениях 10 и 17 атомов углерода и одной группой карбоновой кислоты в положении одного углерода.[1]
В частности, PD1 представляет собой эндогенный стереоселективный липидный медиатор, классифицируемый как автокоид Protein. Аутакоиды - это химические медиаторы ферментативного происхождения с различными биологическими активностями и молекулярными структурами. Протектины - это сигнальные молекулы, которые ферментативно вырабатываются из ненасыщенных жирных кислот. Их молекулярная структура характеризуется наличием сопряженная система двойных связей.[1] PD1, как и другие протекины, продуцируется оксигенацией полиненасыщенной жирной кислоты ω-3. докозагексаеновая кислота (DHA) и содержится во многих тканях, таких как сетчатка, легкие и нервная система.[2][3]
PD1 играет важную роль в качестве противовоспалительной, антиапоптотической и нейропротекторной молекулы. Исследования в Болезнь Альцгеймера модели на животных, у пациентов с инсультом и у людей пигментные эпителиальные клетки сетчатки (RPE) показали, что PD1 потенциально может снизить воспаление индуцированный окислительный стресс и ингибируют проапоптотический сигнал, тем самым предотвращая клеточную дегенерацию.[2][3][4][5] Наконец, недавние исследования патогенности вирусов гриппа, в том числе птичьего гриппа (H5N1), показали, что PD1 потенциально может остановить распространение вируса, тем самым защищая респираторные клетки от летальных вирусных инфекций.[6][7]
Биосинтез PD1
In vivo PD1 в основном продуцируется в ответ на воспалительные сигналы и обнаруживается в различных тканях, таких как пигментные эпителиальные клетки сетчатки, эпителиальные клетки легких, мононуклеарные клетки периферической крови (PBMC) и нервные ткани. Исследования на PBMC показали, что эндогенная DHA, главный предшественник PD1, высвобождается за счет активности фосфолипаза А2.[1][2][3] Согласно этим исследованиям, PD1 преимущественно синтезируется в клетках PBMC с перекосом в клетки типа 2. Т-хелперная клетка фенотип (TЧАС2).[1] Это предполагает, что дифференцировка Т-клеток играет важную роль в активации пути биосинтеза PD1. Взаимодействие PBMC с интерлейкин 4 (IL-4), мощный воспалительный сигнал, приводит к дифференцировке PBMC в TЧАСЛимфоциты 2 типа.[1] Кроме того, активирован TЧАС2 клетки дополнительно высвобождают IL-4, что приводит к активации фермента 15-липоксигеназа -1 (15-ЛО-1).[1] 15-ЛО-1 не-гем железный диоксигеназа который добавляет атомы кислорода в стереоспецифический порядок на свободном и этерифицированном ω-3 полиненасыщенные жирные кислоты как DHA.[3] В целом, биосинтез PD1 проходит через три отдельных этапа, на протяжении которых активность 15-LO-1 важна. На первом этапе биосинтетического пути связывание 15-LO-1 с его субстрат (DHA) приводит к образованию (17S) -гидро (перокси) -DHA промежуточное соединение. Этот промежуточный продукт быстро перерабатывается с образованием молекулы, содержащей 16 (17) -эпоксид, которая является вторым промежуточным продуктом. Наконец, на третьем этапе пути ферментативный гидролиз промежуточного соединения, содержащего 16 (17) -эпоксид, приводит к образованию PD1.[1]

Функции PD1
В целом PD1 in vivo проявляет мощную антиапоптотическую и противовоспалительную активность в тканях, в которых он локализуется. DHA, основной предшественник PD1, в основном обнаруживается в таких тканях, как синапсы сетчатки, фоторецепторы, легкие и мозг, предполагая, что эти ткани с большей вероятностью получат пользу от защитной активности PD1.[1][2][3][4][7][8]
Активность PD1 в сетчатке
RPE необходимы для выживания и обновления фоторецепторов сетчатки. Эти клетки проявляют мощный фагоцитарная активность что обеспечивает правильное функционирование сетчатки. Следовательно, окислительный стресс может потенциально повредить клетки РПЭ и вызвать ухудшение зрения. Исследования на человеческих клетках РПЭ показали, что присутствие молекул, запускающих окислительный стресс, таких как H2О2 вызывает фрагментацию ДНК, которая, в свою очередь, вызывает апоптоз.[2] Эти исследования показали, что PD1 действует как сигнальная молекула и посредством взаимодействия лиганд-рецептор подавляет экспрессию генов, таких как фактор транскрипции NF-κB. Ингибирование NF-κB приводит к подавлению провоспалительного гена СОХ-2 (циклооксигеназа-2 ), который отвечает за выпуск простагландины, мощный провоспалительный медиатор.[2] Кроме того, PD1 играет важную роль в регуляции экспрессии Bcl-2 белки семейства (Bcl-2, Bcl-xL, Bax и Bad), предшествующий выпуску цитохром с комплекс из митохондрий и образование апоптосома.[2][3][4] Присутствие PD1 повышает экспрессию антиапоптотических белков Bcl-2 и Bcl-x.L, в то время как он подавляет экспрессию проапоптотических белков Bax и Bad.[2] В частности, PD1 регулирует это семейство белков, способствуя дефосфорилирование из Bcl-xL к протеинфосфатаза 2А (PP2A) в остатке Сер-62 которые в свою очередь гетеродимеризуется с проапоптотическим белком Bax и инактивирует его.[4] Следовательно, активность белков семейства Bcl-2 приводит к ингибированию каспаза 3 фермент, предотвращающий апоптоз и способствующий выживанию клеток РПЭ.[2][4]
Эффекты PD1 при болезни Альцгеймера
Среди прочего, Болезнь Альцгеймера характеризуется пониженной концентрацией PD1 и повышенной концентрацией амилоид-β пептид (Aβ42), который отвечает за образование старческие бляшки а также вызывает воспаление и апоптоз в нейрональных тканях.[5][9] Aβ42 образуется в результате ферментативного расщепления белок-предшественник β-амилоида (βΑPP) через β- и γ-секретазы. Как и другие провоспалительные медиаторы, Aβ42 вызывает воспаление за счет активации провоспалительного фермента ЦОГ-2 и высвобождения простагландинов. Более того, высвобождение Aβ42 подавляет антиапоптотические белки Bcl-2 и Bcl-x.L и активирует проапоптотические белки Bax и Bad, которые в конечном итоге приводят к образованию апоптосомы.[5][9] PD1 у человека нейрональные глиальные клетки (HNG) запускает подавление β triggerPP, тем самым уменьшая содержание Aβ42 в нейрональных тканях и уменьшая воспаление и апоптоз.[5] В частности, было показано, что PD1 в моделях болезни Альцгеймера реагирует на повышенную концентрацию провоспалительной молекулы Aβ42 путем связывания и активации гамма рецептор, активируемый пролифератором пероксисом (PPARγ) либо напрямую, либо с помощью других механизмов. Согласно некоторым моделям активация PPARγ приводит к увеличению убиквитинирование и деградация βAPP, что снижает высвобождение Aβ42.[5] Кроме того, PD1 ингибирует продукцию пептида Aβ42 путем подавления β-секретазы-1 (BACE1), одновременно повышая регуляцию α-секретазы ADAM10 и секретируемого белка-предшественника амилоида-α (sAPPα). В целом, описанный выше механизм приводит к расщеплению белка βAPP неамилоидогенным путем, который останавливает образование Aβ42 и предотвращает преждевременную дегенерацию нейронов.[5][9]
Противовирусная активность PD1
Исследования культивированных эпителиальных клеток легких человека, инфицированных грипп вируса H1N1 или H5N1 обнаружили, что эндогенная продукция PD1 резко снижается во время инфекции из-за ингибирования 15-LO-1.[6][7] Кроме того, те же исследования показали, что введение PD1 in vivo мышам, инфицированным H1N1, может потенциально ингибировать как пролиферацию вируса, так и воспаление, вызванное инфекцией, тем самым увеличивая выживаемость. PD1 защищает от вирусных инфекций, нарушая жизненный цикл вируса. В частности, PD1 ингибирует связывание вирусной РНК со специфическими факторы ядерного экспорта в клетках-хозяевах, тем самым блокируя экспорт вирусных РНК из ядра в цитозоль.[6][7] Фактор экспорта ядерной РНК 1 (NXF1) представляет особый интерес для ослабления вирусных инфекций за счет активности PD1. В частности, NXF1 транспортер через его середину и С-концевые домены связывается с фенилаланин / глициновыми повторами в нуклеопорины (Nups), которые выравнивают ядерная пора.[7] В отсутствие PD1 вирусная РНК гриппа связывается с транспортером NXF1, который позже специфически связывается с нуклеопорином Nup62 и экспортирует вирусную РНК в цитозоль. Однако введение PD1 показало, что этот липидный медиатор специфически ингибирует связывание вирусной РНК с NXF1, тем самым нарушая пролиферацию вируса.[7]
Лабораторный синтез PD1
Крупномасштабное промышленное производство PD1 представляет большой интерес для фармацевтических компаний, так как они обладают мощным противовоспалительным и антиапоптотическим действием этого липидного медиатора. До сих пор сообщалось об очень небольшом количестве стереоселективных лабораторных синтезов PD1, но с относительно низким выходом.[10][11]
Конвергентный стереоселективный синтез
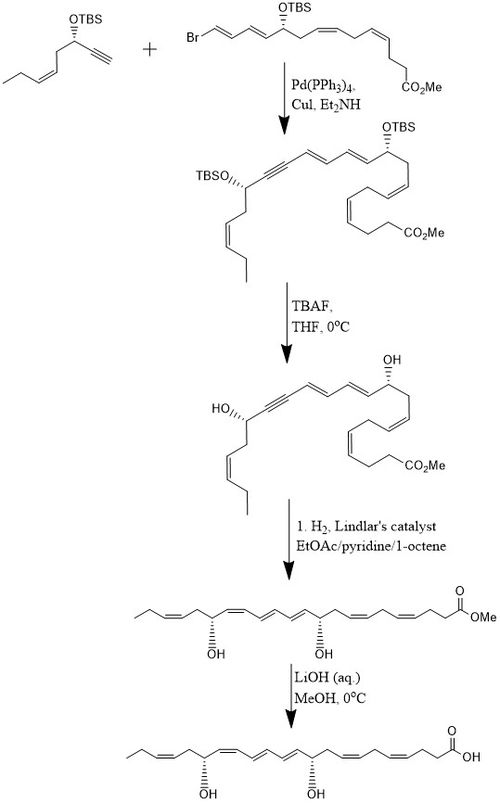
Согласно одному методу PD1 синтезируется с выходом 15% за 8-ступенчатую сходящийся стереоселективный процесс.[10] Первоначально алкин, (Z) -3-трет-бутилдиметилсилокси-окт-5-ен-1-ин реагирует с бром-E,E,Z,Z-тетраен сложный эфир в Реакция кросс-сочетания Соногашира при комнатной температуре в присутствии Pd- (PPh3)4 и CuI с использованием диэтиламин в качестве растворителя, который дает метиловый эфир, защищенный бис-гидроксилом. Удаление двух трет-бутилдиметилсилиловые эфиры (TBS-защитные группы) достигается при избытке TBAF в THF при 0 ° C, что дает диол содержащий сопряженный алкин. Конъюгированный алкин восстанавливается до метилового эфира. Кроме того, диол гидрируют с использованием Катализатор Линдлара, с добавлением 1-октена в качестве жертвенного олефина для получения высокостереоселективного триена, в то время как вода удаляется из диола посредством восстановления Боланда. Наконец, метиловый эфир подвергается омыление при 0 ° C с разбавленным LiOH (водн.) в метанол за которым следует кислый отработка с NaH2PO4 (водн.), чтобы произвести PD1.[10]
Альтернативный стереоселективный синтез
В качестве альтернативы лабораторный синтез PD1 проходит через другой стереоселективный метод.[11] Первоначально, гидроборирование защищенного TBS ацетилен с Sia2BH производит защищенный TBS винилборан. Винилборан, защищенный TBS, реагирует с винилиодидом в присутствии Pd-катализатора, едкий натр (NaOH) и THF для получения TBS-защищенного спирта. Последующая обработка TBS-защищенного спирта TBAF удаляет защитную группу и дает диол. Наконец, диол гидролизуют LiOH в ТГФ (водн.) С получением PD1.[11]

Другие ПД
22-гидрокси-NPD1
22-гидрокси-PD1 (22-OH-PD1; т.е. 10р,17S, 20-тригидрокси-4Z,7Z,11E,13E,15Z,19Z-докозагексаеновая кислота) является омега-окисление продукт PD1, вероятно, образовавшийся в клетках под действием неустановленного Омега-гидроксилаза цитохрома P450 (видеть специализированные проресолирующие медиаторы # Протектины / нейропротектины ). В то время как омега-окисление многих биоактивных метаболитов жирных кислот, таких как лейкотриен B4, 5-HETE, 5-оксо-эйкозатетраеновая кислота (т. е. 5-оксо-ETE) приводит к ~ 100-кратному падению их активности, было показано, что омега-окисленный продукт PD1 обладает сильным противовоспалительным действием и прорезиняющим действием, ингибируя хемотаксис PMN in vivo и in vitro. и снижение уровней провоспалительных медиаторов в воспалительных экссудатах модели на животных до уровней, сопоставимых с PD1.[12][13]
Протектин DX
Protectin DX (PDX; т.е. 10S,17S-дигидрокси-4Z,7Z,11E,13Z,15E,19Z-докозагексаеновая кислота) - 13Z,15E,19Z изомер NPD1 (который имеет 13E,15Z,19Z конфигурация двойной связи) (см. специализированные проресолирующие медиаторы # Протектины / нейропротектины ). Раннее исследование ошибочно использовали PDX вместо PD1 при объяснении антирепликативных и клинически полезных эффектов при вирусном гриппе на мышиной модели PD1.[14] PDX также подавляет приток циркулирующих лейкоциты в брюшину на мышиной модели воспаления.[15] PDX обладает и другим противовоспалительным действием. Подавляет СОХ-1 и СОХ-2 тем самым блокируя образование провоспалительных простагландины; он также подавляет тромбоцит -агрегирующее действие тромбоксан А2 тем самым блокируя реакцию агрегации тромбоцитов на агенты, которые зависят от тромбоксана А2 в зависимости от тромбоцитов.[16]
PD1, вызванный аспирином
PD1, запускаемый аспирином (AT-PD1 или 17-epi-PD1: т.е. 10р,17р-дигидрокси-4Z,7Z,11E,13E,15Z,19Z-докозагексаеновая кислота) 10р-гидрокси-изомер PD1 (который имеет 10S гидроксильный остаток) (см. специализированные проресолирующие медиаторы # Протектины / нейропротектины ). AT-PD1 показал себя а) уменьшить проникновение нейтрофилы в брюшину на мышиной модели воспалительного заболевания; б) стимулировать Эффероцитоз (т.е. поглощение и удаление) нейтрофилов; и в) уменьшить инфаркт мозга и инсульт на модели грызунов.[17]
10-эпи-PD1
10-Epi-PD1 (ent-AT-NPD1: т.е. 10S,17S-Дигидрокси-4Z,7Z,11E,13E,15Z,19Z-докозагексаеновая кислота) 10S-гидрокси-изомер AT-PD1 (который имеет 10р-гидроксильный остаток) (см. специализированные проресолирующие медиаторы # Протектины / нейропротектины ). 10-Epi-PD1 был обнаружен только в небольшом количестве в экстрактах PMN человека, но был более эффективным, чем PD1 или PDX, в блокировании воспалительной реакции на острый перитонит мышей, индуцированный зимозаном A.[13]
Рекомендации
- ^ а б c d е ж грамм час Ариэль А., Ли П.Л., Ван В., Тан В.X., Фредман Дж., Хонг С., Серхан К.Н. (октябрь 2010 г.). «Докозатриеновый протектин D1 продуцируется смещением TH2 и способствует апоптозу Т-клеток человека посредством кластеризации липидных рафтов». J. Biol. Chem. 280 (52): 43079–43086. Дои:10.1074 / jbc.M509796200. PMID 16216871.
- ^ а б c d е ж грамм час я Мукерджи П.К., Марчеселли В.Л., Серхан К.Н., Базан Н.Г. (Июнь 2004 г.). «Нейропротектин D1: докозатриен, полученный из докозагексаеновой кислоты, защищает клетки пигментного эпителия сетчатки человека от окислительного стресса». Proc. Natl. Акад. Sci. Соединенные Штаты Америки. 101 (22): 8491–8496. Дои:10.1073 / pnas.0402531101. ЧВК 420421. PMID 15152078.
- ^ а б c d е ж Каландрия Дж. М., Марчеселли В. Л., Мукерджи П. К., Уддин Дж., Винклер Дж. В., Петасис Н. А., Базан Н. Г. (апрель 2009 г.). «Избирательное спасение выживания в клетках сетчатки с дефицитом 15-липоксигеназы-1 пигментного эпителия с помощью нового медиатора, производного от докозагексаеновой кислоты, нейропротектина D1». J. Biol. Chem. 284 (26): 17877–17882. Дои:10.1074 / jbc.M109.003988. ЧВК 2719426. PMID 19403949.
- ^ а б c d е Энтони Р., Лукив В.Дж., Базан Н.Г. (апрель 2010 г.). «Нейропротектин D1 индуцирует дефосфорилирование Bcl-xL PP2A-зависимым образом во время окислительного стресса и способствует выживанию пигментных эпителиальных клеток сетчатки». J. Biol. Chem. 285 (24): 18301–18308. Дои:10.1074 / jbc.M109.095232. ЧВК 2881755. PMID 20363734.
- ^ а б c d е ж Чжао Ю., Калон Ф., Жюльен С., Винклер Дж. В., Петасис Н. А., Лукив В. Дж., Базан Н. Г. (январь 2011 г.). «Нейропротектин D1, полученный из докозагексаеновой кислоты, индуцирует выживание нейронов с помощью механизмов, опосредованных секретазой и PPARγ, в моделях болезни Альцгеймера». PLOS ONE. 6 (1): e15816. Bibcode:2011PLoSO ... 615816Z. Дои:10.1371 / journal.pone.0015816. ЧВК 3016440. PMID 21246057.
- ^ а б c Гарсия-Састре А (июль 2013 г.). «Уроки липидов в борьбе с гриппом». Клетка. 154 (1): 22–23. Дои:10.1016 / j.cell.2013.06.024. PMID 23827671.
- ^ а б c d е ж Морита М., Куба К., Итикава А., Накаяма М., Катахира Дж., Ивамото Р., Имаи Ю. (март 2013 г.). «Липидный медиатор протектин D1 ингибирует репликацию вируса гриппа и улучшает тяжелые формы гриппа». Клетка. 153 (1): 112–125. Дои:10.1016 / j.cell.2013.02.027. PMID 23477864.
- ^ Серхан К.Н., Готлингер К., Хонг С., Лу И, Сигельман Дж., Баер Т., Петазис Н.А. (февраль 2006 г.). «Противовоспалительное действие нейропротектина D1 / протектина D1 и его природных стереоизомеров: назначение дигидроксисодержащих докозатриенов». J. Immunol. 176 (3): 1848–59. Дои:10.4049 / jimmunol.176.3.1848. PMID 16424216.
- ^ а б c Клементи М.Э., Пеццотти М., Орсини Ф., Сампаолезе Б., Меццогори Д., Грасси С., Мисити Ф. (март 2006 г.). «Амилоидный β-пептид Альцгеймера (1–42) вызывает гибель клеток в нейробластоме человека за счет увеличения соотношения bax / bcl-2: интригующая роль метионина 35». Biochem Biophys Res Commun. 342 (1): 206–213. Дои:10.1016 / j.bbrc.2006.01.137. PMID 16472763.
- ^ а б c Aursnes M, Tungen JE, Vik A, Dalli J, Hansen TV (ноябрь 2013 г.). «Стереоселективный синтез протектина D1: мощного противовоспалительного и прорезавляющего липидного медиатора». Org Biomol Chem. 12 (3): 432–437. Дои:10.1039 / c3ob41902a. ЧВК 3904955. PMID 24253202.
- ^ а б c Огава Н., Кобаяси Ю. (июнь 2011 г.). «Полный синтез противовоспалительного и проресаживающего протеина D1». Tetrahedron Lett. 52 (23): 3001–3004. Дои:10.1016 / j.tetlet.2011.03.152.
- ^ Tungen JE, Aursnes M, Vik A, Ramon S, Colas RA, Dalli J, Serhan CN, Hansen TV (2014). «Синтез, противовоспалительное и пролонгирующее действие 22-OH-PD1, моногидроксилированного метаболита протектина D1». Журнал натуральных продуктов. 77 (10): 2241–7. Дои:10.1021 / np500498j. ЧВК 4208671. PMID 25247845.
- ^ а б Балас Л., Дюран Т. (2016). «Дигидроксилированные E, E, Z-докозатриены. Обзор их синтеза и биологического значения». Прогресс в исследованиях липидов. 61: 1–18. Дои:10.1016 / j.plipres.2015.10.002. PMID 26545300.
- ^ Балас Л., Гишардан М., Дюран Т., Лагард М. (2014). «Путаница между протектином D1 (PD1) и его изомером протектином DX (PDX). Обзор дигидроксидокозатриенов, описанных на сегодняшний день». Биохимия. 99: 1–7. Дои:10.1016 / j.biochi.2013.11.006. PMID 24262603.
- ^ Штейн К., Стоффельс М., Лисон М., Шнайкер Б., Девальд О, Крёнке Г., Калфф Дж. К., Венер С. (2016). «Роль проресолирующих медиаторов, производных 12/15-липоксигеназы, в послеоперационной кишечной непроходимости: регулируемая протекином DX экстравазация нейтрофилов». Журнал биологии лейкоцитов. 99 (2): 231–9. Дои:10.1189 / jlb.3HI0515-189R. PMID 26292977. S2CID 28347830.
- ^ Лагард М., Веричель Э, Лю М., Чен П., Гишардан М. (2014). «Структурно-функциональные отношения продуктов нециклической диоксигеназы из полиненасыщенных жирных кислот: покитрины как класс биоактивных производных». Биохимия. 107 Pt A: 91–4. Дои:10.1016 / j.biochi.2014.09.008. PMID 25223888.
- ^ Серхан К.Н., Далли Дж., Колас Р.А., Винклер Дж. В., Чианг Н. (2015). «Протектины и марезины: новые семейства медиаторов, способствующих рассасыванию острого воспаления и биоактивного метаболома». Biochimica et Biophysica Acta (BBA) - молекулярная и клеточная биология липидов. 1851 (4): 397–413. Дои:10.1016 / j.bbalip.2014.08.006. ЧВК 4324013. PMID 25139562.
внешняя ссылка
- Protectin D1 / Соединение PubChem
- Нейропротектин D1 / База данных метаболома человека (HMDB)
- Protectin D1 / База данных свободной химической структуры (ChemSpider)
- Нейропротектин D1 / База данных пищевых компонентов (FooDB)
- Стратегия нейропротектина D1 / липидных метаболитов и путей метаболизма (LIPID MAPS)
