Ингибитор рибонуклеазы - Ribonuclease inhibitor
| Повторение, богатое лейцином | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
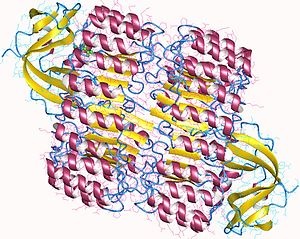
 Вид сверху на ингибитор свиной рибонуклеазы, показывающий его форму подковы.[1] Внешний слой состоит из α-спирали и внутренний слой параллельные β-тяжи. Внутренний и внешний диаметры составляют примерно 2,1 нм и 6,7 нм соответственно. | |||||||||||
| Идентификаторы | |||||||||||
| Символ | LRR_1 | ||||||||||
| Pfam | PF00560 | ||||||||||
| Pfam клан | CL0022 | ||||||||||
| ИнтерПро | IPR003590 | ||||||||||
| УМНАЯ | SM00368 | ||||||||||
| SCOP2 | 1 млрд / Объем / СУПФАМ | ||||||||||
| |||||||||||
Ингибитор рибонуклеазы (ИР) большой (~ 450 остатков, ~ 49 кДа), кислый (pI ~ 4,7), богатый лейцином повтор белок что образует чрезвычайно тесные комплексы с определенными рибонуклеазы. Это основной клеточный белок, составляющий ~ 0,1% от всего клеточного белка по весу, и, по-видимому, играет важную роль в регулировании продолжительности жизни РНК.[2]
RI имеет удивительно высокий цистеин содержание (~ 6,5%, сравните 1,7% в типичных белках) и чувствителен к окислению. RI также богат лейцин (21,5% по сравнению с 9% в типичных белках) и соразмерно ниже в других гидрофобных остатках, особенно. валин, изолейцин, метионин, тирозин, и фенилаланин.
Структура
RI - классический белок с высоким содержанием лейцина, состоящий из чередующихся α-спирали и β-тяжи вдоль его позвоночника. Эти вторичная структура элементы закручены в изогнутый правый соленоид, напоминающий подкова. Параллельные β-тяжи и α-спирали образуют внутреннюю и внешнюю стенки подковы соответственно. Похоже, что конструкция стабилизирована заглубленным аспарагины в основании каждого витка, когда он переходит от α-спирали к β-нити. Повторы αβ чередуются между 28 и 29 остатками в длину, эффективно формируя единицу из 57 остатков, которая соответствует его генетической структуре (каждый экзон коды для единицы с 57 остатками).
Связывание с рибонуклеазами
В близость РИ для рибонуклеаз - одно из самых высоких среди всех белок-белковое взаимодействие; то константа диссоциации РИ-РНКаза А комплекс находится в фемтомолярный (fM) в физиологических условиях, в то время как для RI-ангиогенин комплекс менее 1 фМ. Несмотря на это высокое сродство, RI способен связывать широкий спектр РНКаз A, несмотря на их относительно низкую идентичность последовательности. Оба биохимических исследования и кристаллографический структуры комплексов RI-РНКаза A предполагают, что взаимодействие в значительной степени регулируется электростатический взаимодействия, но также включает в себя существенные скрытые площадь поверхности.[3][4] Сродство RI к рибонуклеазам важно, поскольку многие рибонуклеазы имеют цитотоксический и цитостатический эффекты, которые хорошо коррелируют со способностью связывать РИ.[5]
RI млекопитающих неспособны связываться с некоторыми членами семейства панкреатических рибонуклеаз других видов. Особенно, амфибия РНКазы, такие ранпирназа и амфиназа от Леопардовая лягушка, избегают РИ млекопитающих и, как было отмечено, обладают дифференциальной цитотоксичностью в отношении рак клетки.[6]
Смотрите также
- Тиоцианат гуанидиния - химический ингибитор РНКазы.
Рекомендации
- ^ а б PDB: 2BNH; Кобе Б., Дайзенхофер Дж. (1993). «Кристаллическая структура ингибитора свиной рибонуклеазы, белка с богатыми лейцином повторами». Природа. 366 (6457): 751–6. Дои:10.1038 / 366751a0. PMID 8264799. S2CID 34579479.
- ^ Шапиро Р. (2001). «Ингибитор цитоплазматической рибонуклеазы». Методы в энзимологии. 341: 611–28. Дои:10.1016 / S0076-6879 (01) 41180-3. ISBN 9780121822422. PMID 11582809.
- ^ Ли ФС, Шапиро Р., Валле Б.Л. (январь 1989 г.). «Ингибирование сильного связывания ангиогенина и рибонуклеазы А с помощью плацентарного ингибитора рибонуклеазы». Биохимия. 28 (1): 225–30. Дои:10.1021 / bi00427a031. PMID 2706246.
- ^ Папагеоргиу А.С., Шапиро Р., Ачарья К.Р. (сентябрь 1997 г.). «Молекулярное распознавание ангиогенина человека ингибитором плацентарной рибонуклеазы - рентгеновское кристаллографическое исследование с разрешением 2,0 A». Журнал EMBO. 16 (17): 5162–77. Дои:10.1093 / emboj / 16.17.5162. ЧВК 1170149. PMID 9311977.
- ^ Макаров А.А., Ильинская О.Н. (апрель 2003 г.). «Цитотоксические рибонуклеазы: молекулярное оружие и его мишени». Письма FEBS. 540 (1–3): 15–20. Дои:10.1016 / s0014-5793 (03) 00225-4. PMID 12681476. S2CID 30324366.
- ^ Арделт В., Шоген К., Дарзынкевич З. (июнь 2008 г.). «Онконаза и амфиназа, противоопухолевые рибонуклеазы из ооцитов Rana pipiens». Текущая фармацевтическая биотехнология. 9 (3): 215–25. Дои:10.2174/138920108784567245. ЧВК 2586917. PMID 18673287.
дальнейшее чтение
- Кобе Б., Дайзенхофер Дж. (Март 1995 г.). «Структурная основа взаимодействия между богатыми лейцином повторами и белковыми лигандами». Природа. 374 (6518): 183–6. Дои:10.1038 / 374183a0. PMID 7877692. S2CID 4364436.
- Кобе Б., Дайзенхофер Дж. (Декабрь 1996 г.). «Механизм ингибирования рибонуклеазы белком-ингибитором рибонуклеазы, основанный на кристаллической структуре его комплекса с рибонуклеазой А». Журнал молекулярной биологии. 264 (5): 1028–43. Дои:10.1006 / jmbi.1996.0694. PMID 9000628.
- Папагеоргиу А.С., Шапиро Р., Ачарья К.Р. (сентябрь 1997 г.). «Молекулярное распознавание ангиогенина человека ингибитором плацентарной рибонуклеазы - рентгеновское кристаллографическое исследование с разрешением 2,0 A». Журнал EMBO. 16 (17): 5162–77. Дои:10.1093 / emboj / 16.17.5162. ЧВК 1170149. PMID 9311977.
- Suzuki M, Saxena SK, Boix E, Prill RJ, Vasandani VM, Ladner JE, Sung C, Youle RJ (март 1999 г.). «Инженерная рецептор-опосредованная цитотоксичность в отношении человеческих рибонуклеаз путем стерической блокады взаимодействия ингибиторов». Природа Биотехнологии. 17 (3): 265–70. Дои:10.1038/7010. PMID 10096294. S2CID 23140257.
- Шапиро Р., Руис-Гутьеррес М., Чен Ч.З. (сентябрь 2000 г.). «Анализ взаимодействий человеческого ингибитора рибонуклеазы с ангиогенином и рибонуклеазой А посредством мутагенеза: важность остатков ингибитора внутри по сравнению с внешней С-концевой точкой»"". Журнал молекулярной биологии. 302 (2): 497–519. Дои:10.1006 / jmbi.2000.4075. PMID 10970748.
- Бретчер Л.Е., Абель Р.Л., Рейнс Р.Т. (апрель 2000 г.). «Вариант рибонуклеазы А с низкой каталитической активностью, но высокой цитотоксичностью». Журнал биологической химии. 275 (14): 9893–6. Дои:10.1074 / jbc.275.14.9893. PMID 10744660.
- Яковлев Г.И., Миткевич В.А., Макаров А.А. (2006). «Ингибиторы рибонуклеазы». Молекулярная биология. 40 (6): 867–874. Дои:10.1134 / S0026893306060045. S2CID 31887913.

