Оксалат - Oxalate
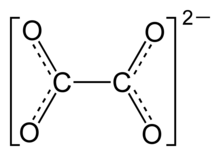 Строение оксалат-аниона | |
 Шариковая модель оксалата | |
| Имена | |
|---|---|
| Имена ИЮПАК | |
| Систематическое название ИЮПАК этандиоат | |
| Другие имена | |
| Идентификаторы | |
3D модель (JSmol ) | |
| 1905970[12][13] | |
| ЧЭБИ | |
| ChemSpider | |
| 2207[14] | |
| КЕГГ | |
PubChem CID | |
| |
| Характеристики | |
| C 2О2− 4[18] | |
| Молярная масса | 88.019 г · моль−1[15][16] |
| Конъюгированная кислота | Гидрогеноксалат[17] |
| Структура | |
| D2ч | |
| Родственные соединения | |
Связанный изоэлектронный | тетроксид диазота |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Оксалат (ИЮПАК: этандиоат) это дианион с формулой C
2О2−
4, также написано (COO)2−
2. Любое название часто используется для производных, таких как соли Щавелевая кислота, Например оксалат натрия Na2C2О4, или же диметил оксалат ((CH3)2C2О4). Оксалат также образует координационные соединения где его иногда сокращают как бык.
Многие ионы металлов образуют нерастворимые осадки с оксалатом, ярким примером является оксалат кальция, основной компонент наиболее распространенного вида камни в почках.
Отношение к щавелевой кислоте
Диссоциация протоны от щавелевой кислоты происходит ступенчато, как и для других полипротонные кислоты. Потеря одного протона приводит к одновалентному гидрогеноксалат анион HC
2О−
4. Соль с этим анион иногда называют кислый оксалат, одноосновный оксалат, или же оксалат водорода. В константа равновесия (Kа ) потери первого протона составляет 5.37×10−2 (пKа = 1,27). Потеря второго протона, которая дает оксалат-ион, имеет константу равновесия 5.25×10−5 (пKа = 4,28). Эти значения означают, что в растворах с нейтральным pH, нет щавелевой кислоты и существуют только следовые количества оксалата водорода.[19] В литературе часто неясно различие между H2C2О4, HC
2О−
4, и C
2О2−
4, а коллекция видов называется щавелевой кислотой.
Структура
Рентгеновская кристаллография простых оксалатных солей показывают, что оксалат-анион может принимать плоскую конформацию с D2ч молекулярная симметрия, или конформация, в которой диэдры O – C – C – O приближаются к 90 ° с приблизительным D2d симметрия.[20] В частности, оксалатный фрагмент принимает плоский, D2ч конформация в твердотельных структурах M2C2О4 (M = Li, Na, K).[21][22] Однако в структуре Cs2C2О4 двугранный угол O – C – C – O равен 81 (1) °.[23][24] Следовательно, Cs2C2О4 более близко аппроксимируется D2d структура симметрии, потому что два CO2 самолеты в шахматном порядке. Две формы Rb2C2О4 были структурно охарактеризованы методом дифракции рентгеновских лучей на монокристаллах; один содержит плоский оксалат, а другой - оксалат в шахматном порядке.
Поскольку предыдущие примеры показывают, что конформация, принимаемая дианионом оксалата, зависит от размера щелочного металла, с которым он связан, некоторые исследовали барьер для вращения вокруг центральной связи C-C. Барьер вращения вокруг этой связи был определен расчетным путем и составлял примерно 2–6 ккал / моль для свободного дианиона, C
2О2−
4.[25][26][27] Такие результаты согласуются с интерпретацией, что центральный углерод-углеродная связь лучше всего рассматривать как одинарную связь с минимальными пи-взаимодействиями между двумя CO−
2 единицы.[20] Этот барьер для вращения вокруг связи C-C (который формально соответствует разнице в энергии между плоской и шахматной формами) может быть отнесен к электростатическим взаимодействиям, поскольку неблагоприятное отталкивание O-O максимизируется в плоской форме.
Важно отметить, что оксалат часто встречается как двузубый, хелатирующий лиганд, например, в ферриоксалат калия. Когда оксалат хелатируется с единственным металлическим центром, он всегда принимает плоскую конформацию.
Встречаемость в природе
Оксалат встречается во многих растениях, где он синтезируется неполным окисление из углеводы.
К растениям, богатым оксалатами, относятся: жирная курица («баранины»), щавель, и несколько Оксалис разновидность. Корень и / или листья ревень и гречневая крупа с высоким содержанием щавелевой кислоты.[28] К другим съедобным растениям, которые содержат значительные концентрации оксалата, относятся, в порядке убывания, карамболы (карамбола ), черный перец, петрушка, мак семя, амарант, шпинат, мангольд, свекла, какао, шоколад, наиболее орехи, наиболее ягоды, рыбий хвост пальмы, Новозеландский шпинат (Тетрагония тетрагониоидес ), и бобы.[нужна цитата ]Листья чай растение (чайный куст ) содержат одни из самых высоких измеренных концентраций щавелевой кислоты по сравнению с другими растениями. Однако напиток, полученный настой в горячей воде обычно содержится от низкого до умеренного количества щавелевой кислоты из-за небольшой массы листьев, используемых для пивоварения.
| Общие продукты с высоким содержанием оксалатов[29] | ||
|---|---|---|
| Еда | Обслуживание | Оксалат Содержание (мг) |
| Свекла зелень, приготовленная | 1⁄2 чашка (единица) | 916 |
| Портулак, листья, приготовленные | 1⁄2 чашка | 910 |
| Ревень тушеная, без сахара | 1⁄2 чашка | 860 |
| Шпинат, приготовленный | 1⁄2 чашка | 750 |
| Свекла, приготовленный | 1⁄2 чашка | 675 |
| Мангольд, Швейцарский, листья приготовленные | 1⁄2 чашка | 660 |
| Ревень, консервы | 1⁄2 чашка | 600 |
| Шпинат, замороженный | 1⁄2 чашка | 600 |
| Свекла маринованный | 1⁄2 чашка | 500 |
| Тыкать зелень, приготовленная | 1⁄2 чашка | 476 |
| Эндивий, сырой | 20 длинных листьев | 273 |
| Какао, сухой | 1⁄3 чашка | 254 |
| Одуванчик зелень, приготовленная | 1⁄2 чашка | 246 |
| Бамия, приготовленный | 8–9 капсул | 146 |
| Сладкий картофель, приготовленный | 1⁄2 чашка | 141 |
| Капуста, приготовленный | 1⁄2 чашка | 125 |
| Арахис, сырой | 1⁄3 чашка (1 3⁄4 унция ) | 113 |
| Репа зелень, приготовленная | 1⁄2 чашка | 110 |
| Шоколад несладкий | 1 унция | 91 |
| Пастернак, нарезанные кубиками, приготовленные | 1⁄2 чашка | 81 |
| Капуста зелень, приготовленный | 1⁄2 чашка | 74 |
| Орехи пекан, половинки, сырые | 1⁄3 чашка (1 1⁄4 унция) | 74 |
| Чай, листья (4-х минутный настой) | 1 уровень чайная ложка через 7 жидкая унция воды | 72 |
| Зерновые зародыши, тосты | 1⁄4 чашка | 67 |
| Крыжовник | 1⁄2 чашка | 66 |
| Картофель, Айдахо белый, запеченный | 1 средний | 64 |
| Морковь, приготовленный | 1⁄2 чашка | 45 |
| яблоко, сырой кожей | 1 средний | 41 |
| брюссельская капуста, приготовленный | 6–8 средний | 37 |
| Клубника, сырой | 1⁄2 чашка | 35 |
| Сельдерей, сырой | 2 стебля | 34 |
| Молочный шоколад бар | 1 бар (1,02 унции) | 34 |
| Малина, черный, сырой | 1⁄2 чашка | 33 |
| апельсин, съедобная часть | 1 средний | 24 |
| зеленая фасоль, приготовленный | 1⁄2 чашка | 23 |
| Чеснок, сырые, нарезанные | 1 столовая ложка | 19 |
| Лук-порей, сырой | 1⁄2 средний | 15 |
| Ежевика, сырой | 1⁄2 чашка | 13 |
| Виноград Конкорд | 1⁄2 чашка | 13 |
| Черника, сырой | 1⁄2 чашка | 11 |
| Красная смородина | 1⁄2 чашка | 11 |
| Абрикосы, сырой | 2 средних | 10 |
| Малина, красный, сырой | 1⁄2 чашка | 10 |
| Брокколи, приготовленный | 1 большой стебель | 6 |
| Клюква сок | 1⁄2 чашка (4 унции) | 6 |
Физиологические эффекты

В организме щавелевая кислота соединяется с двухвалентным металлом. катионы такой как кальций (Ca2+) и утюг (II) (Fe2+) с образованием кристаллов соответствующих оксалатов, которые затем выводятся с моча как мельчайшие кристаллы. Эти оксалаты могут образовывать более крупные камни в почках которые могут закупорить почечные канальцы. По оценкам, 80% камней в почках образуются из оксалата кальция.[30] Те, у кого почка расстройства, подагра, ревматоидный артрит или некоторые формы хронической боли в области вульвы (вульводиния ) обычно рекомендуется избегать продуктов с высоким содержанием щавелевой кислоты.[нужна цитата ]. В настоящее время актуальны методы снижения содержания оксалатов в пище.[31]
Магний (Мг2+) оксалат в 567 раз более растворим, чем оксалат кальция, поэтому последний с большей вероятностью выпадет в осадок при низком уровне магния и высоком уровне кальция и оксалата. Оксалат магния растворим в миллион раз больше, чем Меркурий оксалат. Растворимость оксалатов в металлах уменьшается в следующем порядке: Mg> Ca> CD > Zn> {Mn, Ni, Fe, Cu}> {As, Sb, Pb}> Hg.[сомнительный ]
Сильно нерастворимый оксалат железа (II) кажется, играет важную роль в подагра, в зародышеобразовании и росте иначе чрезвычайно растворимых урат натрия. Это объясняет, почему подагра обычно появляется после 40 лет. [32], когда ферритин уровень в крови превышает 1 мкг / л[нужна цитата ]. Продукты с высоким содержанием оксалатов[33] следует избегать людям, страдающим или подверженным риску подагры.[34]
Кадмий катализирует преобразование Витамин С в щавелевую кислоту. Это может быть проблемой для людей, подвергающихся воздействию высоких уровней кадмия в своем рационе, на рабочем месте или через курение.
В исследованиях на крысах кальциевые добавки, вводимые вместе с продуктами с высоким содержанием щавелевой кислоты, могут вызвать осаждение оксалата кальция в кишечнике и снизить уровень оксалата, усваиваемого организмом (в некоторых случаях на 97%).[35][36]
Щавелевая кислота также может производиться в результате метаболизма этиленгликоль («антифриз»), глиоксиловая кислота, или же аскорбиновая кислота (Витамин С ).[37][сомнительный ]
Порошкообразный оксалат используется как пестицид в пчеловодство бороться с пчелиный клещ.
Немного грибы из род Аспергиллы производят щавелевую кислоту.[38]
Некоторые предварительные данные указывают на то, что администрация пробиотики может положительно влиять на скорость выведения щавелевой кислоты.[39]
Как лиганд
Оксалат, сопряженное основание щавелевой кислоты, является отличным лиганд для ионов металлов. Обычно он связывается как бидентатный лиганд, образуя 5-членный МО.2C2 звенеть. Иллюстративный комплекс ферриоксалат калия, К3[Fe (C2О4)3]. Наркотик оксалиплатин проявляет улучшенную растворимость в воде по сравнению с более старыми платина на основе препаратов, избегая ограничивающих дозу побочных эффектов нефротоксичность. Щавелевая кислота и оксалаты могут окисляться перманганатом в автокаталитической реакции. Одним из основных применений щавелевой кислоты является удаление ржавчины, которое возникает из-за того, что оксалат образует водорастворимые производные с ионом трехвалентного железа.
Избыток
Избыточный уровень оксалата в крови называется гипероксалиемия, а высокий уровень оксалата в моче называется гипероксалурия.
Приобретенный
Хотя это и необычно, потребление оксалатов (например, выпас животных на оксалатсодержащих растениях, таких как Бассия иссопифолистная, или потребление человеком щавель или, особенно в чрезмерных количествах, черный чай ) может привести к заболевание почек или даже смерть из-за отравления оксалатами. Медицинский журнал Новой Англии сообщили об острой оксалатной нефропатии «почти наверняка из-за чрезмерного употребления холодного чая» у 56-летнего мужчины, который выпивал «шестнадцать стаканов холодного чая по 8 унций в день» (примерно 3,8 литра). Авторы статьи выдвинули гипотезу о том, что острая оксалатная нефропатия является недостаточно диагностируемой причиной почечной недостаточности, и предложили тщательно изучить диетический анамнез пациента в случаях необъяснимой почечной недостаточности без протеинурия (избыток белка в моче) и при большом количестве оксалата кальция в осадке мочи.[40] Oxalobacter formigenes в Кишечная флора может помочь облегчить это.[41]
Врожденный
Первичная гипероксалурия это редкое наследственное заболевание, приводящее к увеличению выведения оксалатов, часто встречаются оксалатные камни.
Смотрите также
- Диметил оксалат - (CH3)2C2О4
- Дифенил оксалат - (С6ЧАС5)2C2О4
- Ферриоксалат калия - К3[Fe (C2О4)3], комплекс железа с оксалатными лигандами
- Raphide
- Оксалат натрия - На2C2О4
Рекомендации
- ^ а б c d «Оксалат | C2О4". ChemSpider.
- ^ а б c d «Оксалат». pubchem.ncbi.nlm.nih.gov.
- ^ «оксалат (2-) (CHEBI: 30623)». www.ebi.ac.uk. Получено 1 января 2019.
Название ИЮПАК этандиоат
- ^ «оксалат (2-) (CHEBI: 30623)». www.ebi.ac.uk. Получено 1 января 2019.
338-70-5 Регистрационный номер CAS, ChemIDplus
- ^ «оксалат (2-) (CHEBI: 30623)». www.ebi.ac.uk. Получено 1 января 2019.
ЧЕБИ ID ЧЕБИ: 30623
- ^ «оксалат (2-) (CHEBI: 30623)» (стол). www.ebi.ac.uk. Получено 1 января 2019.
C00209 КЕГГ СОЕДИНЕНИЕ
- ^ «Оксалат | C2О4 | ChemSpider ". www.chemspider.com. п. Подробнее. Получено 1 января 2019.
Стд. InChi InChI = 1S / C2H2O4 / c3-1 (4) 2 (5) 6 / ч (H, 3,4) (H, 5,6) / p-2
- ^ «Оксалат | C2О4 | ChemSpider ". www.chemspider.com. Получено 1 января 2019.
Стд. InChIKey: MUBZPKHOEPUJKR-UHFFFAOYSA-L
- ^ «Оксалат». pubchem.ncbi.nlm.nih.gov. Получено 1 января 2019.
InChI InChI = 1S / C2H2O4 / c3-1 (4) 2 (5) 6 / ч (H, 3,4) (H, 5,6) / p-2
- ^ «Оксалат». pubchem.ncbi.nlm.nih.gov. Получено 1 января 2019.
Ключ InChI: MUBZPKHOEPUJKR-UHFFFAOYSA-L
- ^ «Оксалат». pubchem.ncbi.nlm.nih.gov. Получено 1 января 2019.
Ключ InChI: MUBZPKHOEPUJKR-UHFFFAOYSA-L
- ^ «Оксалат | C2О4 | ChemSpider ". www.chemspider.com. Получено 1 января 2019.
1905970 [Байльштейн]
- ^ «оксалат (2-) (CHEBI: 30623)». www.ebi.ac.uk. Получено 1 января 2019.
1905970 Регистрационный номер в Байльштейне Байльштейн
- ^ «оксалат (2-) (CHEBI: 30623)». www.ebi.ac.uk. Получено 1 января 2019.
2207 Гмелин Регистрационный номер Гмелин
- ^ «оксалат (2-) (CHEBI: 30623)». www.ebi.ac.uk. Получено 1 января 2019.
Чистый сбор -2
- ^ «Оксалат» (стол). pubchem.ncbi.nlm.nih.gov. Получено 1 января 2019.
Формальное обвинение -2
- ^ «оксалат (2-) (CHEBI: 30623)». www.ebi.ac.uk. Получено 2 января 2019.
оксалат (2-) (CHEBI: 30623) представляет собой конъюгированное основание оксалата (1-) (CHEBI: 46904)… оксалат (1-) (CHEBI: 46904) представляет собой конъюгированную кислоту оксалата (2-) (CHEBI: 30623)
- ^ «Оксалат». pubchem.ncbi.nlm.nih.gov. Получено 1 января 2019.
- ^ Рименшнайдер, Вильгельм; Танифудзи, Минору (2000). "Щавелевая кислота". Энциклопедия промышленной химии Ульмана. Дои:10.1002 / 14356007.a18_247. ISBN 3-527-30673-0.
- ^ а б Дин, Филип А. В. (2012). "Оксалат Дианион, C
2О2−
4: Планарный или неплохой? ". Журнал химического образования. 89 (3): 417–418. Bibcode:2012JChEd..89..417D. Дои:10.1021 / ed200202r. - ^ Рид, Д. А .; Олмстед, М. М. (1981). «Уточнение структуры оксалата натрия» (PDF). Acta Crystallographica Раздел B. 37 (4): 938–939. Дои:10.1107 / S0567740881004676.
- ^ Beagley, B .; Смолл, Р. У. Х. (1964). «Строение оксалата лития». Acta Crystallographica. 17 (6): 783–788. Дои:10.1107 / S0365110X64002079.
- ^ На рисунке 81 (1) ° (1) означает, что 1 ° является стандартной неопределенностью измеренного угла 81 °.
- ^ Dinnebier, Robert E .; Венский, Саша; Пантефер, Мартин; Янсен, Мартин (2003). "Кристаллическая и молекулярная структура оксалатов щелочных металлов: первое доказательство шахматного оксалат-аниона в твердом состоянии". Неорганическая химия. 42 (5): 1499–507. Дои:10.1021 / ic0205536. PMID 12611516.
- ^ Кларк, Тимоти; Шлейер, Поль фон Раге (1981). «Конформационные предпочтения 34 валентного электрона A2Икс4 молекулы: Anab initio Исследование B2F4, B2Cl4, N2О4, и C
2О2−
4". Журнал вычислительной химии. 2: 20–29. Дои:10.1002 / jcc.540020106. S2CID 98744097. - ^ Дьюар, Майкл Дж.С .; Чжэн, Я-Цзюнь (1990). «Строение оксалат-иона». Журнал молекулярной структуры: ТЕОХИМА. 209 (1–2): 157–162. Дои:10.1016 / 0166-1280 (90) 85053-П.
- ^ Герберт, Джон М .; Ортис, Дж. В. (2000). "Ab Initio Исследование отрыва электрона в дикарбоксилатных дианионах". Журнал физической химии A. 104 (50): 11786–11795. Bibcode:2000JPCA..10411786H. Дои:10.1021 / jp002657c.
- ^ Штрайтвайзер, Эндрю младший; Хиткок, Клейтон Х. (1976). Введение в органическую химию. Макмиллан. п.737.
- ^ Резник, Мартин I; Пак, Чарльз Ю.С. (1990). Мочекаменная болезнь, медицинский и хирургический справочник. W.B. Компания Сондерс. п. 158. ISBN 0-7216-2439-1.
- ^ Коу; Эван; Вустер (2005). «Почечнокаменная болезнь». Журнал клинических исследований. 115 (10): 2598–608. Дои:10.1172 / JCI26662. ЧВК 1236703. PMID 16200192.
- ^ Betsche, T .; Фрецдорф, Б. (2005). «Биодеградация щавелевой кислоты из шпината с использованием корешков злаков». Журнал сельскохозяйственной и пищевой химии. 53 (25): 9751–8. Дои:10.1021 / jf051091s. PMID 16332126.
- ^ Учебник ортопедии, травматологии и ревматологии (2-е изд.). Mosby Ltd. 2013. с. 204. ISBN 9780702056710.
- ^ «Статья UPMC, Диета с низким содержанием оксалатов».
- ^ «Справочник УГМК: подагра».
- ^ Морозуми, Макото; Хоссейн, Райхан Зубайр; Ямакава, Кеничи; Хокама, Санехиро; Нисидзима, Саори; Оширо, Ёсинори; Учида, Ацуши; Сугая, Кимио; Огава, Ёсихидэ (2006). «Желудочно-кишечная абсорбция щавелевой кислоты у крыс, получавших кальций». Урологическое исследование. 34 (3): 168–72. Дои:10.1007 / s00240-006-0035-7. PMID 16705467. S2CID 35167878.
- ^ Hossain, R. Z .; Ogawa, Y .; Морозуми, М .; Hokama, S .; Сугая, К. (2003). «Молоко и кальций предотвращают всасывание оксалатов в желудочно-кишечном тракте и выведение оксалатов с мочой у крыс». Границы биологических наук. 8 (1–3): a117–25. Дои:10.2741/1083. PMID 12700095.
- ^ Мандл; Szarka; Банхеджи (2009). «Витамин C: обновленная информация по физиологии и фармакологии». Британский журнал фармакологии. 157 (7): 1097–1110. Дои:10.1111 / j.1476-5381.2009.00282.x. ЧВК 2743829. PMID 19508394.
- ^ Пабучуоглу, Угур (2005). «Аспекты оксалоза, связанного с аспергиллезом в образцах патологии». Патология - Исследования и практика. 201 (5): 363–8. Дои:10.1016 / j.prp.2005.03.005. PMID 16047945.
- ^ Lieske, J.C .; Goldfarb, D. S .; De Simone, C .; Ренье, К. (2005). «Использование пробиотика для уменьшения кишечной гипероксалурии». Kidney International. 68 (3): 1244–9. Дои:10.1111 / j.1523-1755.2005.00520.x. PMID 16105057.
- ^ Сайед, Фахд; Мена Гутьеррес, Алехандра; Гаффар, Умбар (2 апреля 2015 г.). "Случай нефропатии холодного чая". Медицинский журнал Новой Англии. 372 (14): 1377–1378. Дои:10.1056 / NEJMc1414481. PMID 25830441. Сложить резюме.
- ^ Siener, R .; Bangen, U .; Сидху, Х .; Hönow, R .; von Unruh, G .; Гессен, А. (2013). «Роль колонизации Oxalobacter formigenes в оксалатнокаменной болезни кальция». Kidney International. 83 (Июнь): 1144–9. Дои:10.1038 / ки.2013.104. PMID 23536130.
