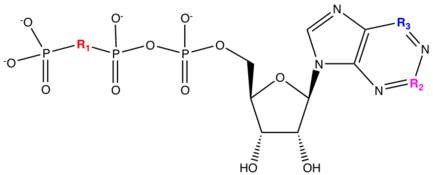
Ингибитор аденозиндифосфатных рецепторов - Adenosine diphosphate receptor inhibitor
Аденозиндифосфат (ADP ) ингибиторы рецепторов площадь класс наркотиков из антиагреганты, используется при лечении острый коронарный синдром (ОКС) или в профилактическом лечении пациентов, которые подвержены риску тромбоэмболия, инфаркт миокарда или Инсульт. Эти препараты противодействуют P2Y12 рецепторы тромбоцитов и, следовательно, предотвращают связывание АДФ с P2Y12 рецептор. Это приводит к снижению агрегации тромбоцитов, препятствуя образованию тромба. P2Y12 рецептор связан с поверхностью белок найдено в крови тромбоциты. Они принадлежат G-белковые пуринергические рецепторы (GPCR) и являются хеморецепторы для ADP.[1]
Первый препарат, средство, медикамент представленный в этом классе был тиклопидин но из-за побочные эффекты сегодня он мало используется. Тиклопидин, клопидогрель и прасугрель (Efient) все тиенопиридины которые вызывают необратимое ингибирование P2Y12 рецептор. Они все пролекарства которые необходимо преобразовать в активный метаболит in vivo для ингибирования P2Y12 рецептор. С другой стороны, новые препараты, такие как тикагрелор (Брилинта®) и Cangrelor (Kengrexal®) не являются тиенопиридинами и обратимо ингибируют P2Y12 это означает, что они действуют непосредственно на рецептор без необходимости метаболической активации и проявляют более быстрое начало и смещение действия.[1][2][3][4]
Эти препараты часто назначают в сочетании с аспирин (ацетилсалициловая кислота) для усиления ингибирования тромбоцитов, особенно у пациентов с ОКС или перенесших чрезкожное коронарное вмешательство (PCI).[5]
История
До появления ингибиторов АДФ единственный антиагрегант агент на рынке для лечения антитромботические события был аспирин. Однако из-за повторяющихся ишемический События у пациентов высокого риска послужили основой для разработки антитромбоцитарных препаратов для воздействия на другие важные сигнальные пути.[5][6]
История ингибиторов АДФ началась в 1972 году, когда исследователи искали препараты, похожие на противовоспалительное средство агент тиноридин, тиенопиридин с противовоспалительным и обезболивающее эффекты, которые были опубликованы двумя годами ранее.[7] На основе знаний химии тиенопиридинов было синтезировано значительное количество производных тиенопиридинов. Производные были протестированы in vivo и ex-vivo у мышей и крыс, но результаты тестов вообще не продемонстрировали каких-либо противовоспалительных или обезболивающих эффектов, а вместо этого показали неожиданные антиагрегантные и антитромботические эффекты. В то время было очень необычно скрининг новых антитромбоцитарных агентов, поскольку связь между агрегацией тромбоцитов, тромбозом и сердечно-сосудистый инциденты оспаривались. Однако для дальнейшей разработки было выбрано наиболее активное производное - тиклопидин.[7] Тиклопидин был тиенопиридином первого поколения, который усиливал ингибирование тромбоцитов и, таким образом, использовался для лечения коронарного синдрома и других сердечно-сосудистых заболеваний. В связи с сообщениями о тяжелых побочных эффектах тиклопидина были разработаны второй и третий тиенопиридины, клопидогрель и прасугрел.[5]
Когда тиклопидин и клопидогрель были впервые представлены на рынке, тиклодипин в 1978 году и клопидогрель в 1998 году, механизм действия этих двух основных антитромботических препаратов не был полностью понят. Было показано, что они являются мощными ингибиторами АДФ-индуцированной агрегации тромбоцитов, но P2Y12 рецептор не был идентифицирован. Кроме того, было ясно, что тиклопидин и клопидогрель являются пролекарствами, что означает, что они неактивны. in vitro и, следовательно, необходимо активировать метаболизм in vivo. Только в 2000 году были выделены и охарактеризованы активные метаболиты этих препаратов. Примерно через год P2Y12 тромбоцитарный рецептор для АДФ был идентифицирован. После этих открытий были постепенно идентифицированы активные метаболиты и ферменты, ответственные за их образование. Таким образом, прошло более 30 лет после открытия тиклопидина, и более чем через 10 лет после открытия клопидогреля был объяснен механизм действия этих двух препаратов.[7]
Развитие
Тиенопиридины
Тиклопидин
Первый P2Y12 ингибиторы принадлежали к семейству тиенопиридинов. Они являются непрямыми антагонистами, которые блокируют агрегацию и активацию тромбоцитов, вызванную АДФ. Первым препаратом этого класса был тиклопидин, который был открыт в 1972 году в компании Porcor (сейчас Санофи ). Это было обнаружено при поиске нового противовоспалительного препарата на основе тиноридина. Он был показан с фенотипический скрининг подход, протестированный как in vivo, так и ex vivo грызун модели. Он показал высокую антиагрегантную активность.[1]
Тиклопидин имел хорошие перспективы и был выбран для клинических испытаний.[1] Он был продан во Франции в 1978 году и стал мировым в 1991 году, когда он вышел на рынок США.[8] для первичной и вторичной профилактики инсульта.[1]
Поиск другого аналога тиенопиридина с лучшей активностью /токсичность соотношение у животных начиналось, как только тиклопидин перешел в доклинические испытания. Поиск нового аналога стал более актуальным после сообщений о пациентах с тяжелой формой гематологический нарушения, вызванные тиклопидином.[8]
Клопидогрель
Клопидогрель, тиенопиридин второго поколения, начало доклинических испытаний в 1987 году и вышел на мировой рынок в 1998 году. Механизм его действия и его предшественник тиклопидин все еще были неизвестны. Единственное, что было известно, это то, что они являются пролекарствами, поскольку они не проявляют никакой активности in vitro, что они необратимо влияют на тромбоциты из-за их длительной продолжительности действия, а активный метаболит был химически и биологически нестабильным. Только в 2000 году был открыт активный метаболит, а год спустя была обнаружена его мишень для тромбоцитов, P2Y12 рецептор АДФ.[8]
Хотя клопидогрел имел лучшее соотношение активность / токсичность, чем тиклопидин, все еще оставались проблемы с его активностью, поскольку у 30% пациентов была устойчивость к клопидогрелу. Основным фактором устойчивости к клопидогрелу является CYP2C19 полиморфизм, который встречается у 30-55% пациентов. Это привело к потере функций фермента, что привело к плохому превращению клопидогреля в его активный метаболит.[1] В метаболит сам по себе очень нестабилен и поэтому не может храниться как часть химическая библиотека.[8] Это привело к разработке соединения, которое меньше зависит от метаболизма, опосредованного CYP, - прасугреля.[1]
Прасугрель
Прасугрел, тиенопиридин третьего поколения, был выведен на рынок в 2009 году фармацевтическими компаниями Daiichi Sankyo / Eli Lilly.[1] Прасугрел, как и его предшественники, является пролекарством, но его метаболизм начинается в кишечнике, где он метаболизируется эстеразой в тиолактон, этот неактивный промежуточный продукт затем подвергается CYP-опосредованному раскрытию цикла, в основном за счет CYP3A4 и CYP2B6 к активному метаболиту. Таким образом, прасугрел не подвержен устойчивости к клопидогрелу.[9][1]
Ингибиторы рецепторов АДФ нового поколения
Тикагрелор
Основное внимание было уделено поиску P2Y12 ингибитор, не являющийся метаболитом, с более быстрым началом действия. Было известно, что АТФ конкурентно противодействует АДФ-индуцированной агрегации тромбоцитов, однако АТФ очень нестабилен. Внимание было направлено на создание аналогов АТФ с более высокой эффективностью и стабильностью. Эти аналоги имели очень короткий период полувыведения из-за удержания трифосфатных групп, поэтому их нужно было вводить внутривенно. Модификация этих аналогов привела к открытию тикагрелора, селективного и стабильного нефосфатного P2Y12 антагонист рецепторов.[10] Тикагрелор относится к классу циклопентилтриазолопиримидинов (ЦПТФ).[11] Тикагрелор появился на рынке в 2010 году в Европе,[12] и 2011 г. в США.[13]
Кангрелор
Кангрелор, другой аналог АТФ, такой как тикагрелор, устойчив к ферментативной деградации. Он имеет быстрое начало действия, поскольку не расщепляется на активный метаболит, такой как тиенопиридины.[14] АстраЗенека получил эксклюзивную лицензию на Cangrelor в декабре 2003 г. В 2009 г. отказался от спонсора исследования фазы 3, где кангрелор испытывался в сравнении с плацебо. Разработка кангрелора была приостановлена на время, когда спонсор отказался от участия после того, как комитет по обзору временного анализа (IARC) решил, что исследование не покажет «убедительную» клиническую эффективность, которая необходима для одобрения регулирующих органов.[15] Однако испытание Champion Phoenix (спонсируемое биофармацевтической компанией The Medicines Company), двойное слепое плацебо-контролируемое испытание, в котором 11145 пациентов, перенесших довольно срочное или плановое ЧКВ, были случайным образом распределены для приема кангрелора или клопидогрела до того, как показало ЧКВ этот кангрелор значительно снизил частоту ишемических событий во время ЧКВ. Кангрелор снижал развитие тромбоза стента больше, чем клопидогрель. Эти результаты были опубликованы в 2013 году.[16] Кангрелор получил FDA одобрение в июне 2015 г. в качестве антиагрегантного препарата для внутривенного применения.[17]
Механизм действия
В молекулярная мишень активного метаболита ингибиторов рецепторов АДФ является P2Y12 рецептор.[18] P2Y12 рецептор представляет собой G-связанный рецептор и активируется аденозиндифосфат. ADP связывается с P2Y12 рецептор, который приводит к угнетению аденилциклаза и тем самым снижает внутриклеточные уровни цАМФ. Это снижение цАМФ снижает фосфорилирование фосфопротеина, стимулированного вазодилататорами, что приводит к активации гликопротеин IIb / IIIa рецепторы.[19] Повышается активация рецепторов гликопротеина IIb / IIIa. тромбоксан производство и длительная агрегация тромбоцитов.[20] Тиклопидин, клопидогрель и прасугрел являются пролекарствами тиенопиридина, которые являются необратимыми ингибиторами тромбоцитов P2Y.12 рецептор. Кангрелор и тикагрелор действуют непосредственно на P2Y.12 ингибиторы, изменяющие конформацию P2Y12 рецептора и, следовательно, приводит к обратимому ингибированию тромбоцитов рецептора. Тиенопиридины метаболизируются в печени и кишечнике до активных метаболитов.[21]

Метаболизм
Тиклопидин является пролекарством и метаболизируется по крайней мере пятью основными путями. Был идентифицирован один активный метаболит, обладающий антитромбоцитарной активностью. Этот активный метаболит образуется CYP-зависимым путем. CYP2C19 и CYP2B6 - ферменты, которые, как предполагается, вносят вклад в метаболическое преобразование тиклопидина в тиолактон промежуточное звено, 2-оксотиклопидин в печени. Промежуточный тиолактон затем превращается в активный метаболит тиклопидина посредством окисления CYP, где окисление происходит активация. Однако CYP ферменты, которые участвуют в этом пути, неизвестны.[21] При образовании активного метаболита были идентифицированы дополнительные метаболиты, и это метаболиты дигидротиенопиридиния (M5) и тиенодигидропиридиния (M6). Эти метаболиты могут быть ответственны за токсические побочные эффекты тиклопидина.[19]
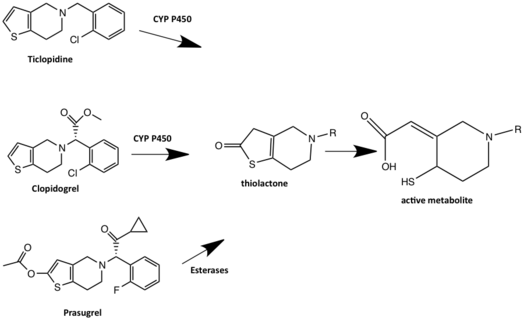
Клопидогрель - это пролекарство, которое метаболизируется двумя путями. По одному из путей большая часть дозы клопидогреля (85%) составляет гидролизованный от эстеразы бездействующему карбоновая кислота производные и быстро выводятся через глюкоридинирование с последующим почечная экскреция. Другой путь клопидогреля требует двухэтапной метаболической активации CYP450 в печени для выработки активного метаболита, который ингибирует P2Y12 рецептор. CYP1A2, CYP3A4, CYP3A5 и CYP2C19 считаются основными ферментами, участвующими в метаболизме клопидогреля.[20] Сначала клопидогрель метаболизируется до 2-оксо-клопидогреля, который, в свою очередь, гидролизуется до активного метаболизма, который представляет собой тиол. Тиол образует дисульфид мост к цистеин в P2Y12 рецептор и, таким образом, необратимо связывается с P2Y12 рецептор. Предполагается, что клопидогрель ковалентно связывается с CYS17 или CYS270 P2Y.12 рецептора и, следовательно, блокирует связывание агониста.[19] Некоторые пользователи клопидогреля имеют недостаточную активность CYP2C19 и, следовательно, плохой метаболизм CYP2C19, что приводит к риску снижения активности клопидогреля. Это связано с тем, что пролекарство не метаболизируется до активного лекарственного средства. Препараты, являющиеся ингибиторами CYP2C19, могут взаимодействовать с клопидогрелом и снижать активность клопидогреля. Все ингибиторы протонной помпы, за исключением рабепразола и пантопразола, метаболизируются печеночным ферментом CYP450 и, следовательно, могут взаимодействовать с метаболизмом клопидогреля. Считается, что омепразол обладает более высоким потенциалом лекарственного взаимодействия, чем другие ингибиторы протеиновой помпы, поскольку он является ингибитором CYP2C19.[18]
Прасугрел - это тиенопиридин третьего поколения и пролекарство. В отличие от тиклопидина и клопидогреля, активация прасугеля включает гидролиз до промежуточного звена. тиолактон, который затем превращается в активный метаболит за один CYP-зависимый этап. Активный метаболит, которым является R-138727 (тиоловый промежуточный продукт), либо необратимо связывается с P2Y12 рецептор или метаболически метилирован в неактивный метаболит. R-138727 метаболически инактивируется посредством S-метилирования. Прасугрел не метаболизируется CYP2C19, как клопидогрел, и генетические варианты CYP не оказывают значительного влияния на активные метаболиты прасугреля. Прасугрел имеет более быстрое начало действия и большую блокировку рецепторов активным метаболитом, чем клопидогрел.[19]
Тикагрелор был первым обратимым ингибитором P2Y12 рецептор, активный после приема внутрь. Тикагрелор активен при пероральном приеме без необходимости какой-либо метаболической активации. Он быстро всасывается и подвергается ферментативной деградации, по крайней мере, до одного активного метаболита, который почти так же эффективен, как и его исходное соединение. Тикагрелор улучшился фармакокинетический и фармакодинамический профили по сравнению с доступными в настоящее время препаратами для лечения ОКС. Кроме того, CYP2C19 генотипы которые, как известно, влияют на эффект клопидогреля, не влияют на действие тикагрелора.[20]
Кангрелор - первый обратимый P2Y12 ингибитор, который может вводиться внутривенно и имеет очень быстрое начало действия и нейтрализацию, что может обеспечить преимущества по сравнению с существующими лекарствами и позволяет кангрелору преодолеть эти ограничения перорального P2Y12 ингибитор. Это делает его привлекательным вариантом для антитромбоцитарной терапии, особенно для пациентов, которые не могут принимать пероральные препараты (например, пациенты без сознания, рвота или седативные препараты). Как и тикагрелор, он не требует метаболических преобразований, чтобы быть активным, и поэтому может напрямую ингибировать P2Y.12 рецептор.[22]
Дизайн лекарств
Взаимосвязь структура-деятельность (SAR)
Прасугрел был разработан с учетом метаболизма. Это было сделано путем замены сложноэфирная группа с метаболически стабильным кетон (группа R1). Кроме того, добавление сложноэфирной группы в положение тиофена 2 (группа R2) сдвинуло первую стадию активации с CYP2C19 на эстеразы и, следовательно, прасугрел не метаболизируется CYP2C19, как клопидогрел.[23]

| Соединение | R1 | R2 | R3 |
| Клопидогрель | 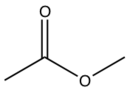 | C | Cl |
| Прасугрель | 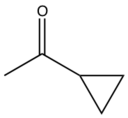 | 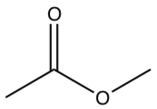 | F |
Кангрелор и тикагрелор - новые классы обратимых P2Y12 рецепторы, которые были разработаны для решения проблем безопасности (кровотечения) и отсутствия ответа, которые есть у тиенопиридинов. Природные лиганды, подобные аденозинтрифосфат (АТФ ) было показано, что он ингибирует агрегацию тромбоцитов и был идентифицирован как слабый антагонист. Кангрелор и тикагрелор являются нуклеотид аналоги, имеющие химическая структура который напоминает аденозинтрифосфат (АТФ).[22] АТФ может метаболизироваться в сердечно-сосудистых тканях до проагрегационного АДФ, АМФ или аденозина. Замена ангидридного кислорода между фосфором β (Pβ) и фосфором γ (Pγ) ди-хлор или ди-фторметиленом приводит к соединению, которое является эквивалентным АТФ и имеет аналогичный pKa. Благодаря этой замене можно избежать метаболизма АТФ в проагрегацию. Добавление S-пропила по длине цепи оказало сильное влияние на активность. Добавление монозамещенного алкиламина в положение С4 аденозина приводило к десятикратному увеличению активности, а также к увеличению длины заместителя алкиламина, что коррелировало с компенсацией эффекта. Добавление метилсульфанилэтиламиногруппы в положение C4 и трифторпропилсульфанила в длину цепи приводит к образованию лекарственного средства кангрелора, обладающего повышенной активностью. Кангрелор имеет 78% -ное среднее восстановление агрегации тромбоцитов, вызванной АДФ, у крыс через 20 минут по сравнению с соединением 1С, у которого восстановление составляет менее 10%.[23]
| Соединение | pIC50 | R1 | R2 | R3 |
|---|---|---|---|---|
| АТФ | 3.6 | О | C | C-NH2 |
| 1А | 3.5 |  | C | C-NH2 |
| 1B | 8.6 |  | C-NH2 | |
| 1С | 9.1 |  | 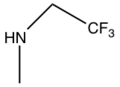 | |
| Кангрелор | 9.4 |  | 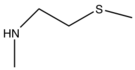 |
Чтобы удовлетворить потребность в обратимом пероральном препарате тикагрелор, фосфатная цепь кангрелора была заменена на аспарагиновая кислота, что приводит к снижению эффективности в 300 раз. Эффективность тикагрелора была возвращена к тому же уровню, что и у кангрелора, путем замены пурина на триазолопиримидин. Сахар рибоза также был заменен на циклопентил группы, чтобы избежать возможной нестабильности гликозидная связь. Группа в левой части конструкции была заменена сайдканом R1. Нейтральный сайдчейн R1 = CONH2 и R1 = CH2ОН были приняты с небольшой потерей аффинности, и метаболизм изменился с желчный к печеночный метаболизм. Из-за этого, in vitro Можно использовать микросомальные тесты печени, которые упростили оптимизацию фармакокинетических свойств. Добавление фенилциклопропиламинового заместителя в положение 5 дает высокое сродство. На основании этого было обнаружено, что первое соединение имеет измеримый пероральный биодоступность у крыс (R1 = CH2ОЙ). Вариация R2 оказала незначительное влияние на аффинность, что позволило ввести группы для улучшения фармакокинетических свойств, например R1 = OCH2CH2ОЙ. Введение фтора на фенильное кольцо и на конце тиоэфирной алкильной цепи приводит к дальнейшему улучшению метаболической стабильности. Заменяя фтор в тиоэфирной алкильной цепи обратно на S-пропил, это приводит к образованию тикагрелора.[23]

| Соединение | pIC50 | R1 | R2 | R3 | R4 | R5 |
|---|---|---|---|---|---|---|
| АТФ | 3.6 | 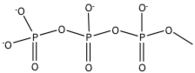 | C | О | C-NH2 | C |
| 2А | 7.0 |  | C | О |  | |
| 2B | 9.3 |  | N | C |  | |
| 2C | COOH = 9,3 CONH2 =7.7 CH2ОН = 7,1 | COOH, CONH2 или CH2ОЙ | N | C |  | |
| 2D | COOH = 9,6 CONH2=8.8 CH2ОН = 8,3 H = 8,6 ОСН2CH2ОН = 8,5 | COOH, CONH2, CH2ОН, Н или ОСН2CH2ОЙ | N | C |  | |
| 2E | 9.2 | ОСН2CH2ОЙ | N | C |  | |
| Тикагрелор | 8.3 | ОСН2CH2ОЙ | N | C |  |
Клиническое использование
Активация тромбоцитов и последующая агрегация тромбоцитов играет решающую роль в поддержании нормального гемостаз. Нарушение в этой системе может привести к цереброваскулярный, сердечно-сосудистые и заболевания периферических сосудов где это может привести к инсульту, нестабильная стенокардия и инфаркт миокарда. При повреждении сосуда АДФ высвобождается из поврежденных клеток и активированных тромбоцитов, вызывая дальнейшую агрегацию тромбоцитов.[24][25]
Тиклопидин
Тиенопиридин P2Y первого поколения12 блокатор рецепторов тиклопидин был исключен из клинического использования из-за высокой частоты побочных эффектов, таких как тромботический тромбоцитопеническая пурпура, апластическая анемия и нейтропения.[26] Клиническое применение препарата быстро затмил клопидогрель, поскольку у последнего было меньше желудочно-кишечный побочные эффекты и лучше гематологический безопасность.[27]
Клопидогрель
Тиенопиридин второго поколения P2Y12 Блокатор рецепторов клопидогрель представляет собой эффективное антитромбоцитарное средство, используемое для лечения ишемического высвобождения цереброваскулярных, сердечных и периферических артерий.[28] Как и другие тиенопиридиновые препараты, при клиническом применении препарат часто комбинируют с аспирином.[24] Клинически одобренная доза клопидогреля составляет 300 мг. ударная доза PO и 75 мг в день поддерживающая доза ПО.[29]
На протяжении многих лет двойное лечение с циклооксигеназа-1 Ингибитор (ЦОГ-1) аспирин и клопидогрель были рутинной практикой и служили основными антиагрегантами для предотвращения тромботических событий, поскольку они обладают способностью сильно влиять на биологию тромбоцитов, которая играет центральную роль в тромбозе. Однако использование этих агентов по-прежнему подвержено ряду важных ограничений, таких как повышенный риск заражения. кровотечение, что делает длительность и дозировку клопидогреля первостепенной важностью. Кроме того, реакция на клопидогрель неоднородна, и низкий ответ может привести к основные неблагоприятные сердечно-сосудистые события.[30][31]
Новые поколения
Новое поколение P2Y12 Блокаторы были направлены на решение этих проблем, обещая улучшение результатов для пациентов. Эти недавно разработанные P2Y12 блокаторы (тикагрелор, кангрелор, прасугрель и элиногрель) обеспечивают более стойкое и сильное ингибирование тромбоцитов, более эффективно противодействуя P2Y12 рецептор. Однако это более сильное ингибирование тромбоцитов происходит за счет более высокого риска кровотечения.[32][30]
Прасугрель, тиенопиридин третьего поколения, метаболизируется в организме более эффективно, чем клопидогрель и тиклопидин, и поэтому в большей степени предотвращает активацию тромбоцитов. Исследования показали, что прасугрел снижает риск тромбоза стента и инфаркта миокарда до гораздо большего уровня, чем клопидогрел.[27] Клинически одобренная доза прасугрела - это ударная доза 60 мг перорально и поддерживающая доза 10 мг в день перорально.[29]
Тикагрелор намного больше мощный ингибитор агрегации тромбоцитов, чем клопидогрель, однако он связан с учащением эпизодов одышки у пациентов. Эти эпизоды могут варьироваться от легкой до средней степени тяжести. Утвержденная клиническая доза тикагрелора составляет 180 мг перорально ударной дозы и 90 мг дневной поддерживающей дозы.[33]
Единственный родительский препарат, нацеленный на P2Y12 Рецептором в клиническом применении является кангрелор.[34]
Взаимодействия
Фермент CYP2C19 метаболизирует ингибиторы протонной помпы (ИПП), а также клопидогрел. В различных отчетах указывалось, что существует отрицательный препарат клопидогрел-омепразол. взаимодействие. Некоторые исследования показали, что активность клопидогреля в отношении тромбоцитов значительно снижалась у пациентов, получавших лечение омепразол, ингибитор протонной помпы (ИПП).[35][36] Другое исследование также показало лансопразол оказывать тормозящее влияние на активность клопидогреля.[37] Однако другие исследования показали, что потребление ИПП пантопразол или эзомепразол не быть связано с нарушением ответа на клопидогрель.[36][38]
В 2009 г. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA ) и Европейское агентство по лекарствам (EMA) не одобряли комбинацию клопидогреля и ИПП, особенно омепразола, из-за наблюдений, сделанных в то время в ходе первоначальных когортных исследований. Однако новее ретроспектива когортные исследования не показали неблагоприятных сердечно-сосудистых событий, вызванных взаимодействиями клопидогрел-ИПП. Следовательно, нет определенных доказательств влияния лекарственного взаимодействия на смертность.[39]
Для пациентов с высоким риском желудочно-кишечного кровотечения риск перевешивает возможные неблагоприятные сердечно-сосудистые эффекты. Поэтому этим пациентам следует рекомендовать комбинировать клопидогрель с ИПП, в меньшей степени ингибирующими CYP2C19, такими как пантопразол.[39]
Устойчивость к клопидогрелу
Устойчивость к клопидогрелу возникла с годами и стала серьезной проблемой для лечения пациентов с ОКС или перенесших ЧКВ. Сообщается, что устойчивость к клопидогрелу колеблется от 4 до 44% между разными препаратами. население и этнический группы. У пациентов с резистентностью к клопидогрелю наблюдается более низкая активность ингибирования тромбоцитов из-за снижения уровней активного метаболита клопидогреля. Это приводит к серии клинических инцидентов, например ишемические и тромбоэмболические осложнения. Эти пациенты считаются плохо или не отвечающими на лечение.[40][41]
Клопидогрель - это пролекарство, которое требует двухэтапного метаболизма с помощью ферментов, чтобы стать активным метаболитом. Одним из важнейших ферментов метаболизма клопидогреля является CYP2C19, который участвует в обоих этапах биотрансформации. Полиморфизм фермента CYP2C19 влияет на ответ на клопидогрель, следовательно, снижает ферментативную активность и, следовательно, снижает уровень активного метаболита клопидогреля.[41]
Основной проблемой устойчивости к клопидогрелу является взаимодействие с другими лекарственными средствами, особенно с ингибитором протонной помпы омепразолом. Омепразол и клопидогрель метаболизируются одним и тем же путем метаболизма CYP. Следовательно, было высказано предположение, что низкая чувствительность клопидогреля при одновременном применении омепразола вызвана конкуренцией фермента CYP2C19 между этими двумя препаратами.[41]
Клинические подходы к преодолению резистентности к клопидогрелу включают более высокие дозы клопидогреля, одновременное применение с ингибитор фосфодиэстеразы цилостазол или переход на новый антиагрегант, такой как прасугрел и тикагрелор. Тем не менее, основная проблема этих методов - повышенный риск кровотечения. Следовательно, критически важна потребность в новом антитромбоцитарном агенте с быстрым началом действия, меньшей вариабельностью реакции у разных людей и улучшенным профилем безопасности.[40]
Будущие перспективы
Разработка ингибиторов АДФ постоянно развивается, и поиски еще лучшего P2Y12 антагонистов все еще продолжается.[1] Краеугольным камнем вторичной профилактики атеротромботических событий у пациентов с ОКС или перенесших ЧКВ является двойная антиагрегантная терапия аспирином и клопидогрелом. Тем не менее, события атеротромбоза все же имеют место.[42] Ограничения нынешних антитромбоцитарных препаратов включают риск кровотечения и индивидуальную вариабельность ответа на ингибирование тромбоцитов.[6]
Цель состоит в том, чтобы определить оптимальную терапевтическое окно для максимизации терапевтических преимуществ при одновременном снижении проблем безопасности, таких как кровотечение. Следовательно, основная неудовлетворенная цель ингибиторов АДФ - разработать мощный обратимый антиагрегант с быстрым началом действия, высоким уровнем антиагрегантной активности, но сниженным риском кровотечений. Эта сложная задача вместе с ежедневным оральным профилем и оптимизированной селективностью, возможно, станет важным прорывом в этой области.[1][40]
Vicagrel - новейшая разработка в этом секторе по состоянию на сентябрь 2017 года. Новый ацетатный аналог клопидогреля, который, как ожидается, обеспечит улучшенную антиагрегантную эффективность, а также снизит риск кровотечения.[43] Предварительные фармакокинетические исследования викагрела показали более высокую биодоступность, чем клопидогрел, что указывает на гораздо более низкую терапевтически эффективную дозу викагрела. Преимуществами викагрела перед клопидогрелом являются отсутствие лекарственной устойчивости для слабых метаболизаторов CYP2C19, снижение дозозависимой токсичности из-за более низкой эффективной дозы и более быстрого начало действия.[40]
использованная литература
- ^ а б c d е ж г час я j k Мартинес, Ана; Гил, Кармен, ред. (2017-07-19). Комплексная лечебная химия. Том 1, Общая перспектива - будущее открытия лекарств (3-е изд.). Амстердам, Нидерланды. ISBN 9780128032008. OCLC 989872324.[страница нужна ]
- ^ «Европейское агентство по лекарственным средствам. 2017. Efient». EMA. Получено 2017-09-22.
- ^ «Европейское агентство по лекарственным средствам. 2017. Brilique». EMA. Получено 2017-09-22.
- ^ «Европейское агентство по лекарствам. 2017. Kengrexal». EMA. Получено 2017-09-22.
- ^ а б c К., Чопра, Х. (30 декабря 2012 г.). Учебник кардиологии: клиническая и историческая перспектива. Нанда, Навин К. (Навин Чандар), 1937-. Нью-Дели. ISBN 9789350900819. OCLC 870265462.[страница нужна ]
- ^ а б Angiolillo, Dominick J .; Луис Феррейро, Хосе (январь 2010 г.). «Антагонизм рецепторов аденозиндифосфата P2Y12 тромбоцитов: преимущества и ограничения текущих стратегий лечения и будущих направлений». Revista Española de Cardiología. 63 (1): 60–76. Дои:10.1016 / с 1885-5857 (10) 70010-4. PMID 20089227.
- ^ а б c Мафран, Жан-Пьер (август 2012 г.). «История клопидогреля и его предшественника, тиклопидина: можно ли сегодня открыть и разработать эти основные антиагрегантные и антитромботические препараты?». Comptes Rendus Chimie. 15 (8): 737–743. Дои:10.1016 / j.crci.2012.05.006.
- ^ а б c d Мафран, Жан-Пьер (август 2012 г.). «История клопидогреля и его предшественника, тиклопидина: можно ли сегодня открыть и разработать эти основные антиагрегантные и антитромботические препараты?». Comptes Rendus Chimie. 15 (8): 737–743. Дои:10.1016 / j.crci.2012.05.006.
- ^ Смолл, Д. С .; Wrishko, R.E .; Ernest II, C.S .; Ni, L .; Винтерс, К. Дж .; Фарид, Н. А .; Li, Y.G .; Brandt, J. T .; Салазар, Д. Э .; Borel, A. G .; Kles, K. A .; Пейн, К. Д. (октябрь 2009 г.). «Фармакокинетика и фармакодинамика прасугрела у пациентов с умеренной почечной недостаточностью и терминальной стадией почечной недостаточности». Журнал клинической фармации и терапии. 34 (5): 585–594. Дои:10.1111 / j.1365-2710.2009.01068.x. PMID 19744014.
- ^ Синха, Накул (сентябрь 2012 г.). «Тикагрелор: от молекулярных открытий до клинических данных». Индийский журнал сердца. 64 (5): 497–502. Дои:10.1016 / j.ihj.2012.09.002. ЧВК 3861097. PMID 23102389.
- ^ Стори, Роберт (6 декабря 2017 г.). «Фармакология и клинические испытания обратимо связывающихся ингибиторов P2Y12». Тромбоз и гемостаз. 105 (S 06): S75 – S81. Дои:10.1160 / THS10-12-0769. PMID 21479343.
- ^ "ОТЧЕТ ОБ ОЦЕНКЕ БРИЛИК" (PDF).
- ^ «FDA одобрило разжижающий кровь препарат Брилинта для лечения острых коронарных синдромов».
- ^ Angiolillo, Dominick J .; Капранцано, Пьера (август 2008 г.). «Фармакология новых ингибиторов тромбоцитов». Американский журнал сердца. 156 (2): 10С – 15С. Дои:10.1016 / j.ahj.2008.06.004. PMID 18657681.
- ^ Вуд, Шелли (13 мая 2009 г.). «Испытания CHAMPION с кангрелором остановлены из-за недостаточной эффективности». Medscape. Получено 2017-09-29.
- ^ Bhatt, Deepak L .; Стоун, Грегг У .; Mahaffey, Kenneth W .; Гибсон, К. Майкл; Стег, П. Габриэль; Hamm, Christian W .; Прайс, Мэтью Дж .; Леонарди, Серджио; Гэллап, Дайанн; Брамуччи, Эцио; Радке, Питер В .; Видимский, Петр; Тоусек, Франтишек; Таут, Джеффри; Сприггс, Дуглас; McLaurin, Brent T .; Angiolillo, Dominick J .; Женереукс, Филипп; Лю, Тьепу; Пратс, Джейн; Тодд, Мередит; Скерянец, Симона; Уайт, Харви Д .; Харрингтон, Роберт А. (4 апреля 2013 г.). «Влияние ингибирования тромбоцитов кангрелором во время ЧКВ на ишемические события». Медицинский журнал Новой Англии. 368 (14): 1303–1313. Дои:10.1056 / NEJMoa1300815. PMID 23473369.
- ^ Norgard, Николас Б .; Hann, Callie L .; Дейл, Джордж Л. (15 сентября 2008 г.). «Кангрелор ослабляет образование тромбоцитов с покрытием». Клинический и прикладной тромбоз / гемостаз. 15 (2): 177–182. Дои:10.1177/1076029608321437. PMID 18796456.
- ^ а б Валлентин, Л. (24 июля 2009 г.). «Ингибиторы P2Y12: различия в свойствах и механизмах действия и потенциальные последствия для клинического применения». Европейский журнал сердца. 30 (16): 1964–1977. Дои:10.1093 / eurheartj / ehp296. PMID 19633016.
- ^ а б c d Lemke, Thomas L .; Уильямс, Дэвид А., ред. (2013). Принципы медицинской химии Фуа (7-е изд.). Филадельфия: Wolters Kluwer Health / Lippincott Williams & Wilkins. ISBN 9781451175721. OCLC 748675182.[страница нужна ]
- ^ а б c Дамман, Питер; Вудстра, пирс; Kuijt, Wichert J .; де Винтер, Робберт Дж .; Джеймс, Стефан К. (20 декабря 2011 г.). «Ингибирование тромбоцитов P2Y12 в клинической практике». Журнал тромбоза и тромболизиса. 33 (2): 143–153. Дои:10.1007 / s11239-011-0667-5. ЧВК 3269569. PMID 22183178.
- ^ а б Фарид, Надь А .; Курихара, Ацуши; Райтон, Стивен А. (февраль 2010 г.). «Метаболизм и расположение тиенопиридиновых антитромбоцитарных препаратов тиклопидина, клопидогреля и прасугреля у людей». Журнал клинической фармакологии. 50 (2): 126–142. Дои:10.1177/0091270009343005. PMID 19948947.
- ^ а б Сибле, Александра М .; Наварскас, Джеймс Дж. (2017). «Кангрелор». Кардиология в обзоре. 25 (3): 133–139. Дои:10.1097 / CRD.0000000000000142. PMID 28379902.
- ^ а б c Зеттерберг, Фредрик; Свенссон, Педер (июнь 2016 г.). «Состояние дел: дизайн и взаимосвязь между структурой и активностью обратимых антагонистов рецептора P2Y 12». Письма по биоорганической и медицинской химии. 26 (12): 2739–2754. Дои:10.1016 / j.bmcl.2016.04.030. PMID 27133596.
- ^ а б Холлопетер, Гюнтер; Янцен, Ханс-Михаэль; Винсент, Диана; Ли, Джорджия; Англия, Лаура; Рамакришнан, Ванита; Ян, Руэй-Бинг; Нурден, Пахита; Нурден, Алан; Юлий, Давид; Конли, Памела Б. (январь 2001 г.). «Идентификация рецептора ADP тромбоцитов, на который нацелены антитромботические препараты». Природа. 409 (6817): 202–207. Дои:10.1038/35051599. ProQuest 204499734.
- ^ Сугидачи, Атсухиро; Асаи, Фумитоши; Огава, Такетоши; Иноуэ, Терухико; Коике, Хироюки (апрель 2000 г.). «Фармакологический профиль CS-747, нового антитромбоцитарного агента со свойствами антагониста рецептора ADP тромбоцитов». Британский журнал фармакологии. 129 (7): 1439–1446. Дои:10.1038 / sj.bjp.0703237. ЧВК 1571986. PMID 10742300.
- ^ Виджеератне, Януши Даллеве; Хептинстолл, Стэн (октябрь 2011 г.). «Антитромбоцитарная терапия: антагонисты рецептора АДФ». Британский журнал клинической фармакологии. 72 (4): 647–657. Дои:10.1111 / j.1365-2125.2011.03999.x. ЧВК 3187865. PMID 21518389.
- ^ а б Бхатт, Дипак Л. (3 сентября 2009 г.). «Прасугрель в клинической практике». Медицинский журнал Новой Англии. 361 (10): 940–942. Дои:10.1056 / NEJMp0806848. ProQuest 223915809.
- ^ Geiger, J .; Brich, J .; Hönig-Liedl, P .; Eigenthaler, M .; Schanzenbächer, P .; Herbert, J.M .; Уолтер, У. (август 1999 г.). «Специфическое нарушение передачи сигналов, опосредованной рецептором АДФ P2YAC тромбоцитов человека антитромбоцитарным препаратом клопидогрелом». Артериосклероз, тромбоз и биология сосудов. 19 (8): 2007–2011. Дои:10.1161 / 01.atv.19.8.2007. PMID 10446085.
- ^ а б Angiolillo, Dominick J .; Бейтс, Эрик Р .; Басс, Теодор А. (август 2008 г.). «Клинический профиль прасугрела, нового тиенопиридина». Американский журнал сердца. 156 (2): 16С – 22С. Дои:10.1016 / j.ahj.2008.06.005. PMID 18657682.
- ^ а б Сарафов, Николаус; А. Бирн, Роберт; Сиббинг, Дирк (23 сентября 2012 г.). «Клиническое применение клопидогрела». Текущий фармацевтический дизайн. 18 (33): 5224–5239. Дои:10.2174/138161212803251853. PMID 22724411.
- ^ Тан, Цзе; Ли, Му-Пэн; Чжоу, Хун-Хао; Чэнь, Сяо-Пин (25 августа 2015 г.). «Агенты ингибирования тромбоцитов: текущие и будущие антагонисты рецептора P2Y12». Современная сосудистая фармакология. 13 (5): 566–577. Дои:10.2174/1570161112666141127162209. PMID 25440595.
- ^ Ахмад, Шираз; Ф. Стори, Роберт (23 сентября 2012 г.). «Разработка и клиническое использование прасугрела и тикагрелора». Текущий фармацевтический дизайн. 18 (33): 5240–5260. Дои:10.2174/138161212803251989. PMID 22724412.
- ^ Стори, Роберт Ф .; Беккер, Ричард С .; Харрингтон, Роберт А .; Хастед, Стин; Джеймс, Стефан К .; Остужает, Фрэнк; Стег, Филипп Габриэль; Хурми, Нардев С .; Эмануэльссон, Хокан; Купер, Анна; Кэрнс, Ричард; Кэннон, Кристофер П .; Валлентин, Ларс (декабрь 2011 г.). «Характеристика одышки у пациентов из исследования PLATO, получавших тикагрелор или клопидогрель, и ее связь с клиническими исходами». Европейский журнал сердца. 32 (23): 2945–2953. Дои:10.1093 / eurheartj / ehr231. PMID 21804104.
- ^ Hensch, Nicole R .; Карим, Зубайр А .; Пинеда, Джошуа; Меркадо, Николь; Alshbool, Fatima Z .; Хасауна, Фади Т. (ноябрь 2017 г.). «Антитело P2Y 12 подавляет активность тромбоцитов и защищает от тромбообразования». Сообщения о биохимических и биофизических исследованиях. 493 (2): 1069–1074. Дои:10.1016 / j.bbrc.2017.09.083. PMID 28928091.
- ^ Жилард, Мартина; Арно, Бертран; Корнили, Жан-Кристоф; Ле Галь, Грегуар; Лакут, Карине; Ле Кальвез, Женевьева; Мансурати, Жак; Моттье, Доминик; Абграл, Жан-Франсуа; Бошат, Жак (январь 2008 г.). «Влияние омепразола на антиагрегантное действие клопидогреля, связанного с аспирином». Журнал Американского колледжа кардиологии. 51 (3): 256–260. Дои:10.1016 / j.jacc.2007.06.064. PMID 18206732.
- ^ а б Сиббинг, Дирк; Морат, Таня; Стегерр, Юлия; Браун, Зигмунд; Фогт, Вольфганг; Хадамицкий, Мартин; Шёмиг, Альберт; Кастрати, Аднан; Бекерат, Николас фон (23 ноября 2017 г.). «Влияние ингибиторов протонной помпы на антиагрегантные эффекты клопидогреля» (PDF). Тромбоз и гемостаз. 101 (04): 714–719. Дои:10.1160 / TH08-12-0808. PMID 19350116.
- ^ Small, David S .; Фарид, Надь А .; Пейн, Кристофер Д.; Weerakkody, Govinda J .; Li, Ying G .; Брандт, Джон Т .; Salazar, Daniel E .; Уинтерс, Кеннет Дж. (Апрель 2008 г.). «Влияние ингибитора протонной помпы лансопразола на фармакокинетику и фармакодинамику прасугрела и клопидогреля». Журнал клинической фармакологии. 48 (4): 475–484. Дои:10.1177/0091270008315310. PMID 18303127.
- ^ Силлер-Матула, Йоланта М .; Шпиль, Александр О .; Ланг, Ирен М .; Крайнер, Герхард; Господи, Гюнтер; Джилма, Бернд (январь 2009 г.). «Влияние пантопразола и эзомепразола на ингибирование тромбоцитов клопидогрелом». Американский журнал сердца. 157 (1): 148.e1–148.e5. Дои:10.1016 / j.ahj.2008.09.017. PMID 19081411.
- ^ а б Дреппер, Майкл Д.; Spahr, L; Фроссар, JL (2012). «Клопидогрель и ингибиторы протонной помпы - где мы находимся в 2012 году?». Всемирный журнал гастроэнтерологии. 18 (18): 2161. Дои:10.3748 / wjg.v18.i18.2161. ЧВК 3351765. PMID 22611308.
- ^ а б c d Шан, Цзяци; Чжан, Бою; Чжу, Яоцю; Цзяо, Бо; Чжэн, Вэйи; Ци, Сяовэй; Гонг, Яньчунь; Юань, Фанг; Lv, Fusheng; Сун, Хунбинь (2 апреля 2012 г.). «Преодоление устойчивости к клопидогрелу: открытие викагрела как высокоэффективного и перорально биодоступного антитромбоцитарного агента». Журнал медицинской химии. 55 (7): 3342–3352. Дои:10.1021 / jm300038c. PMID 22428882.
- ^ а б c Vlachojannis, GJ; Димитропулос, G; Алексопулос, Д. (2011). «Устойчивость к клопидогрелу: современные аспекты и будущие направления». Греческий журнал кардиологии. 52 (3): 236–45. PMID 21642072.
- ^ Capodanno, D .; Ferreiro, J. L .; Ангиолилло, Д. Дж. (Июнь 2013 г.). «Антиагрегантная терапия: новые фармакологические средства и изменение парадигм». Журнал тромбоза и гемостаза. 11: 316–329. Дои:10.1111 / jth.12219. PMID 23809135.
- ^ Коллинз, Роберт Джон; Чан, Чи-Винг (15 сентября 1989 г.). «Колоректальная карцинома в китайском Гонконге. Патологическое исследование 1117 случаев, 1972–1981». Международный журнал рака. 44 (3): 410–414. Дои:10.1002 / ijc.2910440305. ЧВК 5054534. PMID 2777406.
