Рецептор P2Y - Википедия - P2Y receptor
| Часть серия на |
| Пуринергическая сигнализация |
|---|
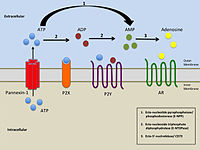 Упрощенная иллюстрация внеклеточной пуринергической передачи сигналов |
| Концепции |
| Мембранные транспортеры |
P2Y рецепторы семья пуринергический G-белковые рецепторы, стимулированный нуклеотиды Такие как АТФ, ADP, UTP, UDP и UDP-глюкоза[1]. На сегодняшний день у человека клонировано 8 рецепторов P2Y: P2Y1, P2Y2, P2Y4, P2Y6, P2Y11, P2Y12, P2Y13 и P2Y14.[2]
Рецепторы P2Y присутствуют практически во всех ткани человека где они осуществляют различные биологические функции на основе их связывания с G-белками. Рецепторы P2Y опосредуют реакции, включая вазодилатацию,[3] свертывание крови,[4] и иммунный ответ.[5] Из-за своей повсеместности и разнообразия функций они являются обычным биологическая мишень в фармакологические разработки.[4]
Структура

Рецепторы P2Y мембранные белки принадлежащий к класс А семья G-белковые рецепторы (GPCR).[6][7] Белки рецептора P2Y демонстрируют крупномасштабные структурные домены, типичные для GPCR, состоящие из семи гидрофобных трансмембранные спирали соединены тремя короткими внеклеточными петлями и тремя внутриклеточными петлями различного размера; внеклеточный N-конец; и внутриклеточный C-конец.[8] Внеклеточные области взаимодействуют с лигандами рецептора, в то время как внутриклеточные области активируют G-белок, контролируют интернализацию рецептора и опосредуют димеризацию.[7] Подобно другим GPCR, рецепторы P2Y могут образовывать как гомодимеры и гетеродимеры. Эти димерные формы могут значительно отличаться по своим биохимическим и фармакологическим свойствам от мономерного рецептора.
Помимо структурных доменов, типичных для всех GPCR, некоторые структурные элементы являются общими для подтипов рецепторов P2Y. Все рецепторы P2Y содержат четыре внеклеточных цистеин остатки, которые могут образовывать два дисульфидные мостики, один между N-концевым доменом и проксимальной внеклеточной петлей, а другой - между двумя оставшимися внеклеточными петлями.[7] Было показано, что эти дисульфидные связи участвуют в связывание лиганда и преобразование сигнала.[9] Кроме того, несколько полярных остатков, обнаруженных в трансмембранных спиралях, высоко консервативны как для видов, так и для подтипов рецепторов. Мутационный анализ показал, что эти остатки являются неотъемлемой частью механизма связывания лиганда рецепторов P2Y. За пределами этих консервативных областей семейство рецепторов P2Y демонстрирует необычно высокое разнообразие в первичная структура, с P2Y1 разделяя только 19% своей первичной структуры с P2Y12.[7] Несмотря на это, отдельные подтипы P2Y высоко консервативны у разных видов, при этом человеческие и мышиные рецепторы P2Y разделяют 95% аминокислот.
Механизмы связывания лигандов рецепторов P2Y в настоящее время хорошо не установлены.[9] В связующий комплекс рецепторов P2Y с АТФ представляет значительный интерес, поскольку ни один рецептор P2Y не содержит аминокислотных последовательностей, подобных любому из многих установленных сайтов связывания АТФ.[8] Недавний рентгеновская кристаллография человека P2Y12 Рецептор обнаружил несколько структурных нарушений в областях, которые обычно высококонсервативны в GPCR.[9]
В отличие от необычной структуры и поведения доменов связывания внеклеточного лиганда, внутриклеточные домены P2Y, по-видимому, структурно и механически сходны с другими GPCR.[7]
Передача сигнала
Рецепторы P2Y реагируют положительно или отрицательно на присутствие нуклеотидов во внеклеточном растворе.[10] Нуклеотиды можно разделить на две категории: пурины и пиримидины. Отдельные виды рецепторов P2Y могут реагировать только на пурины, только на пиримидины или на оба; профили активации восьми известных рецепторов P2Y перечислены ниже.[10]
| P2Y виды | Восприимчивость |
|---|---|
| P2Y1 | Активация пуринами[10] |
| P2Y2 | Активация пуринами и трифосфатами пиримидинов[10] |
| P2Y4 | Активация пиримидинами[10] |
| P2Y6 | Активация пиримидинами[10] |
| P2Y11 | Активация пуринами[10] |
| P2Y12 | Инактивация ADP через G1 белок[10] |
| P2Y13 | Инактивация ADP через G1 белок[10] |
| P2Y14 | Активация UDP-глюкозой[10] |
Активность рецепторов P2Y связана с сигнальным каскадом, возникающим при регуляции потока Ca2+ и K+ ионы за счет взаимодействия рецептора с G-белками, модулируя доступ к Ca2+ и K+ каналов, хотя точное поведение зависит от отдельных видов рецепторов.[11] Независимый от напряжения Ca2+ каналы позволяют свободный поток Ca2+ ионы из клетки, активируемые рецепторами P2Y.[11] Колебание Са2+ концентрация напрямую зависит от активности передачи сигнала P2Y1; в частности, посредством фосфорилирования протеинкиназой C Thr339 на карбокси-конце P2Y1 рецептор.[11]
Изменения концентрации Ca2+ имеют много важных разветвлений для клетки, включая регуляцию клеточного метаболизма (например, аутофагия инициация / регуляция), производство АТФ (через Ca2+ проникновение во внешнюю митохондриальную мембрану и стимуляция митохондриальных дегидрогеназ, приводящая к продукции АТФ), а также возможность запуска апоптоз.[12][13] И аутофагия, и апоптоз - это реакции клеток на стресс, которые играют важную роль в общей жизненные циклы, хотя аутофагия направлена на сохранение жизнеспособности клетки за счет рециркуляции отдельных частей органелл, в то время как апоптоз действует в интересах всего организма за счет клетки, подвергающейся апоптозу.[13]
Фармакология

Многие обычно назначаемые лекарства нацелены на рецепторы P2Y, и ведутся активные исследования по разработке новых лекарств, нацеленных на эти рецепторы.[4] Наиболее часто назначаемый препарат, нацеленный на рецепторы P2Y, - клопидогрель, антиагрегантные препараты который действует на P2Y12 рецептор таким же образом, как и другие тиенопиридины.[15] Другие фармацевтические применения включают денуфозол, который нацелен P2Y2 и исследуется на предмет лечения кистозный фиброз, и диквафозол, P2Y2 агонист используется при лечении болезни сухого глаза.[16][17][18]
P2Y6 рецепторы, как было показано, играют роль в церебральном расширение сосудов. UDP -аналоги, которые связываются с этим рецептором, были исследованы как возможные способы лечения мигрень.[19][18]
P2Y11 является регулятором иммунного ответа и распространенным полиморфизм перевозят почти 20% стран Северной Европы кавказцы дают повышенный риск инфаркта миокарда, делая P2Y11 интересный лекарственный целевой кандидат для лечения инфаркт миокарда.[5][17][18]
В дополнение к установленным применениям, были проведены фармацевтические исследования роли рецепторов P2Y в остеопороз,[3] сахарный диабет,[20] и кардиозащита.[21][18]
Связь
Биологические эффекты активации рецептора P2Y зависят от того, как они связаны с нижележащими сигнальными путями, либо через граммя, граммв / 11 или же граммs G белки. Рецепторы P2Y человека имеют следующие соединения с G-белками:[22]
| Протеин | Ген | Связь | Нуклеотид |
| P2RY1 | P2RY1 | граммв / 11 | ADP |
| P2RY2 | P2RY2 | граммв / 11 (и Gя) | АТФ, UTP |
| P2RY4 | P2RY4 | граммв / 11 (и Gя) | UTP |
| P2RY5 / LPA6 | LPAR6 | Лизофосфатидная кислота[23] | |
| P2RY6 | P2RY6 | граммв / 11 | UDP |
| P2RY8 | P2RY8 | сиротский рецептор | |
| P2RY9 / LPAR4 / GPR23 | LPAR4 | Лизофосфатидная кислота | |
| P2RY10 | P2RY10 | сиротский рецептор | |
| P2RY11 | P2RY11 | граммв / 11 и Gs | АТФ |
| P2RY12 | P2RY12 | граммя | ADP |
| P2RY13 | P2RY13 | граммя | ADP |
| P2RY14 | P2RY14 | граммя | UDP-глюкоза |
Пробелы в нумерации рецепторов P2Y связаны с тем, что несколько рецепторов (P2Y3, P2Y5, P2Y7, P2Y8, P2Y9, P2Y10) при клонировании считались рецепторами P2Y, хотя на самом деле это не так.
Смотрите также
Рекомендации
- ^ «Пуринергические (P2Y) рецепторы». Tocris Bioscience. Получено 2020-11-12.
- ^ Abbracchio MP, Burnstock G, Boeynaems JM, Barnard EA, Boyer JL, Kennedy C, Knight GE, Fumagalli M, Gachet C, Jacobson KA, Weisman GA (сентябрь 2006 г.). «Международный фармакологический союз LVIII: обновленная информация о рецепторах нуклеотидов, связанных с белком P2Y G: от молекулярных механизмов и патофизиологии к терапии». Фармакологические обзоры. 58 (3): 281–341. Дои:10.1124 / пр.58.3.3. ЧВК 3471216. PMID 16968944.
- ^ а б Romanello M, Bivi N, Pines A, Deganuto M, Quadrifoglio F, Moro L, Tell G (октябрь 2006 г.). «Бисфосфонаты активируют передачу сигналов нуклеотидных рецепторов и индуцируют экспрессию Hsp90 в остеобластоподобных клеточных линиях». Кость. 39 (4): 739–53. Дои:10.1016 / j.bone.2006.03.011. PMID 16697713.
- ^ а б c Эрлинге Д. (01.01.2011). «Рецепторы P2Y в здоровье и болезни». Фармакология пуриновых и пиримидиновых рецепторов. Успехи фармакологии. 61. С. 417–39. Дои:10.1016 / B978-0-12-385526-8.00013-8. ISBN 9780123855268. PMID 21586366.
- ^ а б Амистен С., Меландер О., Вильборг А.К., Берглунд Г., Эрлинге Д. (январь 2007 г.). «Повышенный риск острого инфаркта миокарда и повышенный уровень С-реактивного белка у носителей варианта Thr-87 рецептора АТФ P2Y11». Европейский журнал сердца. 28 (1): 13–8. Дои:10.1093 / eurheartj / ehl410. PMID 17135283.
- ^ Якобсон К.А., Джаясекара депутат, Костанзи С. (сентябрь 2012 г.). «Молекулярная структура рецепторов P2Y: мутагенез, моделирование и химические исследования». Междисциплинарные обзоры Wiley: мембранный транспорт и передача сигналов. 1 (6): 815–827. Дои:10.1002 / wmts.68. ЧВК 3547624. PMID 23336097.
- ^ а б c d е фон Кюгельген I, Харден Т.К. (2011). «Глава 12: Молекулярная фармакология, физиология и структура рецепторов P2Y». В Jacobson KA, Linden J (ред.). Фармакология пуриновых и пиримидиновых рецепторов. Эльзевир. С. 373–399. ISBN 978-0-12-385526-8. Получено 8 ноября 2018.
- ^ а б Дубяк, Джордж Р. (2013). «Рецепторы P2Y». Энциклопедия биологической химии (2-е изд.). Кливленд, Огайо: Elsevier Inc., стр. 375–378. Дои:10.1016 / B978-0-12-378630-2.00350-9. ISBN 978-0-12-378631-9.
- ^ а б c Zhang K, Zhang J, Gao ZG, Zhang D, Zhu L, Han GW и др. (Май 2014 г.). «Структура человеческого рецептора P2Y12 в комплексе с антитромботическим препаратом». Природа. 509 (7498): 115–8. Bibcode:2014Натура.509..115Z. Дои:10.1038 / природа13083. ЧВК 4174307. PMID 24670650.
- ^ а б c d е ж грамм час я j Тулапуркар М.Э., Шефер Р., Ханк Т., Флорес Р.В., Вейсман Г.А., Гонсалес Ф.А., Райзер Г. (июнь 2005 г.). «Механизм эндоцитоза нуклеотидного рецептора P2Y2, меченного зеленым флуоресцентным белком: зависимость от клатрина и актина цитоскелета». Клеточные и молекулярные науки о жизни. 62 (12): 1388–99. Дои:10.1007 / s00018-005-5052-0. PMID 15924261.
- ^ а б c Ван Колен К., Слегерс Х (сентябрь 2006 г.). «Интеграция путей передачи сигнала, активируемых рецептором P2Y, в G-белковые сигнальные сети». Пуринергическая передача сигналов. 2 (3): 451–69. Дои:10.1007 / s11302-006-9008-0. ЧВК 2254474. PMID 18404483.
- ^ Хайноцки Г., Чордас Г., Дас С., Гарсия-Перес К., Саотоме М., Синха Рой С., Йи М. (01.11.2006). «Передача сигналов кальция в митохондриях и гибель клеток: подходы к оценке роли захвата митохондриального Ca2 + в апоптозе». Клеточный кальций. 40 (5–6): 553–60. Дои:10.1016 / j.ceca.2006.08.016. ЧВК 2692319. PMID 17074387.
- ^ а б Decuypere JP, Bultynck G, Parys JB (сентябрь 2011 г.). «Двойная роль Ca (2+) в регуляции аутофагии». Клеточный кальций. 50 (3): 242–50. Дои:10.1016 / j.ceca.2011.04.001. PMID 21571367.
- ^ Долл Дж., Цайтлер Э, Беккер Р. (июль 2013 г.). «Дженерик клопидогрел: время заменить?». JAMA. 310 (2): 145–6. Дои:10.1001 / jama.2013.7155. PMID 23839745.
- ^ фон Кюгельген I (2017). 12 рецептор. Достижения экспериментальной медицины и биологии. 1051. С. 123–138. Дои:10.1007/5584_2017_98. ISBN 978-981-10-7610-7. PMID 28921447.
- ^ Пераль А., Домингес-Годинес, Колорадо, Карраседо Дж., Пинтор Дж. (Апрель 2008 г.). «Терапевтические мишени при синдроме сухого глаза». Новости и перспективы наркотиков. 21 (3): 166–76. PMID 18560615.
- ^ а б Ван Х.Х., Ху Дж.Х., Се Р., Ян С.М., Донг Х. (май 2016 г.). «Важная роль рецепторов P2Y в воспалении и раке пищеварительной системы». Oncotarget. 7 (19): 28736–47. Дои:10.18632 / oncotarget.7518. ЧВК 5053759. PMID 26908460.
- ^ а б c d фон Кюгельген I, Хоффманн К. (май 2016 г.). «Фармакология и структура рецепторов P2Y». Нейрофармакология. 104: 50–61. Дои:10.1016 / j.neuropharm.2015.10.030. PMID 26519900.
- ^ Мальмшё М., Хоу М., Пендергаст В., Эрлинге Д., Эдвинссон Л. (май 2003 г.). «Мощные опосредованные рецептором P2Y6 сокращения в мозговых артериях человека». BMC Фармакология. 3 (1): 4. Дои:10.1186/1471-2210-3-4. ЧВК 156657. PMID 12737633.
- ^ Амистен С., Мейдуте-Абаравичене С., Тан С., Олде Б., Лундквист И., Салехи А., Эрлинге Д. (сентябрь 2010 г.). «АДФ опосредует ингибирование секреции инсулина путем активации рецепторов P2Y13 у мышей». Диабетология. 53 (9): 1927–34. Дои:10.1007 / s00125-010-1807-8. PMID 20526761.
- ^ Ицхаки С., Шайнберг А., Чепорко Ю., Видне Б. А., Саги А., Якобсон К. А., Хоххаузер Е. (октябрь 2006 г.). «Уридин-5'-трифосфат (UTP) уменьшает размер инфаркта и улучшает функцию сердца крыс после инфаркта миокарда». Биохимическая фармакология. 72 (8): 949–55. Дои:10.1016 / j.bcp.2006.07.019. ЧВК 4429760. PMID 16939682.
- ^ Комитет по номенклатуре генов HUGO, Семейство генов: Пуринергические рецепторы P2Y (P2RY), получено 2017-01-26.
- ^ Пастернак С.М., фон Кюгельген I, Абуд К.А., Ли Я.А., Рюшендорф Ф., Фосс К., Хиллмер А.М., Мольдерингс Г.Дж., Франц Т., Рамирес А., Нюрнберг П., Нётен М.М., Бец Р.С. (март 2008 г.). «Рецептор P2Y5, связанный с G-белком, и его лиганд LPA участвуют в поддержании роста волос человека». Природа Генетика. 40 (3): 329–34. Дои:10,1038 / нг.84. PMID 18297070.
внешняя ссылка
- Ивар фон Кюгельген: Фармакология P2X- и P2Y-рецепторов млекопитающих, Обзоры BIOTREND № 03, сентябрь 2008 г., © 2008 BIOTREND Chemicals AG
- «Рецепторы P2Y». База данных рецепторов и ионных каналов IUPHAR. Международный союз фундаментальной и клинической фармакологии.
- Пуринергические + P2 + рецепторы в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
