Кинин – калликреиновая система - Kinin–kallikrein system
В кинин – калликреиновая система или просто кининовая система плохо понимаемый гормональная система с ограниченными доступными исследованиями.[1] Он состоит из крови белки которые играют роль в воспаление,[2] артериальное давление контроль, коагуляция и боль. Его важные посредники брадикинин и каллидин находятся вазодилататоры и действуют на многие типы клеток.
История
Система была открыта в 1909 году, когда исследователи обнаружили, что инъекция моча (высокое содержание кининов) привело к гипотония (низкое кровяное давление).[3] Исследователи Эмиль Карл Фрей, Генрих Краут и Ойген Верле обнаруженный высокомолекулярный кининоген в моче около 1930 г.[4]
Этимология
kinin [Gk] kīn (eîn) двигаться, приводить в движение. kallikrein [Gk] kalli ~ sweet и kerin = kreos, плоть, названная в честь экстракта поджелудочной железы, где он был впервые обнаружен
Члены
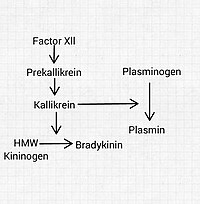
Система состоит из нескольких крупных белков, некоторые из которых полипептиды и группа ферментов, которые активируют и дезактивируют соединения.
Белки
Кининоген с высоким молекулярным весом (HMWK) и низкомолекулярный кининоген (LMWK) являются предшественниками полипептидов. У них нет активности сами по себе.
- HMWK вырабатывается печенью вместе с прекалликреином (см. Ниже). Он действует в основном как кофактор при свертывании и воспалении и не обладает собственной каталитической активностью.
- LMWK локально продуцируется многочисленными тканями и секретируется вместе с тканевым калликреином.
Полипептиды
- Брадикинин (BK), который действует на рецептор B2 и немного на B1, производится, когда калликреин высвобождает его из HMWK. Это нонапептид (9 аминокислот) с аминокислота последовательность Arg – Pro – Pro – Gly – Phe – Ser – Pro – Phe – Arg.
- Каллидин (KD) высвобождается из LMWK тканевым калликреином. Это декапептид. KD имеет ту же аминокислотную последовательность, что и брадикинин, с добавлением лизина на N-конце, поэтому иногда его называют Lys-брадикинином.
HMWK и LMWK образуются путем альтернативного сплайсинга одного и того же гена.[5]
Ферменты
- Калликрейнс (калликреин ткани и плазмы) сериновые протеазы которые освобождают родственников[6] (BK и KD) из кининогенов, которые представляют собой белки плазмы, которые превращаются в вазоактивные пептиды.[7] Прекалликреин является предшественником калликреина плазмы. Он может активировать кинины только после активации самим фактор XIIa или другие раздражители.
- Карбоксипептидазы присутствуют в двух формах: N циркулирует и M мембраносвязанный. Они удаляют остатки аргинина на карбокси-конце BK и KD.
- Фермент, превращающий ангиотензин (ACE), также называемый кининаза II, инактивирует ряд пептидных медиаторов, включая брадикинин. Более известен тем, что активирует ангиотензин.
- Нейтральная эндопептидаза также дезактивирует кинины и другие медиаторы.
Фармакология
Подавление АПФ с помощью Ингибиторы АПФ приводит к снижению конверсии ангиотензина I в ангиотензин II (a сосудосуживающее средство ), но также к увеличению брадикинина из-за снижения деградации. Это объясняет, почему у некоторых пациентов, принимающих ингибиторы АПФ, появляется сухой кашель, а у некоторых возникает реакция: ангионевротический отек, опасная опухоль в области головы и шеи.
Есть гипотезы, что многие положительные эффекты ингибиторов АПФ связаны с их влиянием на систему кинин-калликреин. Это включает их эффекты в артериальная гипертензия, в ремоделирование желудочков (после инфаркта миокарда) и, возможно, диабетическая нефропатия.
Роль в болезни
Дефекты кинин-калликреиновой системы при заболеваниях обычно не распознаются. Система является предметом множества исследований из-за ее связи с воспаление и артериальное давление системы. Известно, что кинины являются медиаторами воспаления, вызывающими расширение кровеносных сосудов и повышенную проницаемость сосудов. Кинины - это небольшие пептиды, вырабатываемые калликреином из кининогена и расщепляемые кининазами. Они действуют на фосфолипазу и увеличивают арахидоновая кислота высвобождают и, следовательно, простагландин (PGE2 ) производство.
C1-INH Вовлечение
С1-ингибитор представляет собой белок-ингибитор сериновой протеазы (серпин). C1-INH является наиболее важным физиологическим ингибитором калликреина плазмы, fXIa и fXIIa. C1-INH также ингибирует протеиназы фибринолитического, свертывающего и кининового путей. Дефицит C1-INH способствует активации калликреина в плазме, что приводит к выработке вазоактивного пептида брадикинина.
Рекомендации
- ^ Сет (1 января 2008 г.). Учебник фармакологии. Эльзевир Индия. стр. 603–. ISBN 978-81-312-1158-8. Получено 25 ноября 2010.
- ^ Дюшен (2011). «Калликреин-кининовая система при воспалительных заболеваниях». Кинины. Де Грюйтер. С. 261–272. ISBN 978-3-11-025235-4.
- ^ Абелус Дж. Э., Бардье Э. (1909). «Лечебные гипотензивные вещества нормальной человеческой мочи». CR Soc Biol (На французском). 66: 511–20.
- ^ Краут H, Фрей EK, Werle E (1930). "Der Nachweis eines Kreislaufhormon in der Pankreasdrüse". Z Physiol Chem Хоппе-Зейлера. 189 (3–4): 97–106. Дои:10.1515 / bchm2.1930.189.3-4.97.[постоянная мертвая ссылка ]
- ^ Фармакология Гудмана и Гилмана; Глава 24. Гистамин, брадикинин и их антагонисты
- ^ Стефан Офферманнс; Уолтер Розенталь (2008). Энциклопедия молекулярной фармакологии. Springer. С. 673–. ISBN 978-3-540-38916-3. Получено 11 декабря 2010.
- ^ Кумар, В., Аббас, А., Фаусто, Н. (Редакторы) Роббинс и Котран, патологические основы болезни. 7-е изд. Филадельфия: Elsevier 2005; стр. 65.
внешняя ссылка
- Система Калликреин-Кинин + в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)

