Ремоделирование желудочков - Ventricular remodeling
В кардиология, ремоделирование желудочков (или же ремоделирование сердца)[1] относится к изменениям размера, формы, структуры и функция из сердце. Это может произойти в результате упражнение (физиологическое ремоделирование) или после травмы сердечной мышцы (патологическое ремоделирование).[2] Травма обычно возникает из-за острый инфаркт миокарда (обычно трансмуральный инфаркт или инфаркт с подъемом сегмента ST), но может быть вызван рядом причин, которые приводят к увеличению давление или же объем, вызывая перегрузка по давлению или же перегрузка по объему (формы напряжения) на сердце. Хронический гипертония, врожденный порок сердца с внутрисердечным шунтированием, и порок клапанов сердца также может привести к ремоделированию. После того, как происходит оскорбление, серия гистопатологический и структурные изменения происходят в миокарде левого желудочка, которые приводят к прогрессивному снижению производительности левого желудочка. В конечном итоге ремоделирование желудочков может привести к снижению сократительной способности (систолический ) функция и приведенная ударный объем.
Физиологическое ремоделирование обратимо, в то время как патологическое ремоделирование в большинстве случаев необратимо. Ремоделирование желудочков под давлением левого / правого делает несоответствия неизбежными. Несоответствие патологического давления между легочным и системным кровообращением ведет к компенсаторному ремоделированию левого и правого желудочков. Термин «обратное ремоделирование» в кардиологии подразумевает улучшение механики и функции желудочков после отдаленной травмы или патологического процесса.[3][4][5]
Ремоделирование желудочков может включать: гипертрофия желудочков, расширение желудочков, кардиомегалия, и другие изменения. Это аспект кардиомиопатия, которых существует множество типов. Концентрическая гипертрофия возникает из-за перегрузка по давлению, а эксцентрическая гипертрофия возникает из-за перегрузка по объему.[6]
Патофизиология
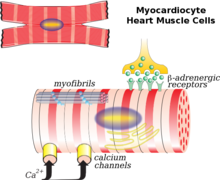
В кардиомиоцит это основная клетка, участвующая в ремоделировании. Фибробласты, коллаген, интерстиций и коронарные сосуды в меньшей степени тоже играют роль. Обычный сценарий ремоделирования - после инфаркта миокарда. Есть миокард некроз (гибель клеток) и непропорциональное истончение сердца. Эта тонкая, ослабленная область не может выдерживать давление и объемную нагрузку на сердце так же, как и другие здоровые ткани. В результате происходит расширение камеры, выходящей из области инфаркта. Начальная фаза ремоделирования после инфаркта миокарда приводит к восстановлению некротической области и рубцевание миокарда это может в некоторой степени считаться полезным, поскольку наблюдается улучшение или поддержание функции ЛЖ и сердечный выброс. Однако со временем, когда сердце претерпевает постоянные изменения, оно становится менее эллиптическим и более сферическим. Увеличиваются масса и объем желудочков, что вместе отрицательно влияет на сердечную функцию. В итоге, диастолический функция или способность сердца расслабляться между сокращениями может быть нарушена, что приведет к дальнейшему снижению.[7]
После инфаркта миокарда (ИМ) смерть сердечных миоцитов может быть вызвана: некроз, апоптоз, или же аутофагия, приводящее к истончению сердечной стенки.[8] Выжившие сердечные миоциты располагаются параллельно или последовательно друг другу, что способствует расширению желудочков или гипертрофии желудочков, в зависимости от нагрузки на стенку желудочка.[7] Кроме того, снижена экспрессия мизоина V1 и Кальциевые каналы L-типа на сердечные миоциты также считается причиной ремоделирования сердца. В нормальных условиях организма жирная кислота составляет от 60 до 90% энергообеспечения сердца. После ИМ, поскольку окисление жирных кислот снижается, это приводит к снижению энергоснабжения сердечных миоцитов, накоплению жирных кислот до токсичных уровней и дисфункции митохондрии. Эти последствия также привели к усилению оксидативного стресса на сердце, вызывая распространение фибробласты, активация металлопротеиназы, и индукция апоптоза, что будет объяснено ниже. Кроме того, воспалительный иммунный ответ после ИМ также способствует указанным изменениям.[8]
Кроме того, сердечный интерстиций, состоящий в основном из коллагеновых волокон типа I и типа III, также участвует в ремоделировании сердца. Сердечный коллаген синтезируется фибробластами и расщепляется металлопротеиназами.[7] Фибробласты активируются после ИМ, что приводит к усилению синтеза коллагена и фиброзу сердца.[8] Увеличить выражение MMP1 и MMP9 привело к деградации коллагеновых волокон и, как следствие, к расширению сердца.[7] Несколько сигнальных путей, таких как Ангиотензин II, Преобразование фактора роста в бета (TGF-бета) и Эндотелин 1 как известно, запускают синтез и разрушение коллагеновых волокон в сердце.[8]
Другие факторы, такие как высокое кровяное давление, активация симпатической системы, которая высвобождает норэпинефрин, активация ренин-ангиотензиновая система который выпускает ренин и антидиуретические гормоны являются важными участниками ремоделирования сердца. Тем не мение, предсердный натрийуретический пептид считается кардиозащитным.[7]
Оценка
Ремоделирование сердца оценивается путем выполнения эхокардиограмма. С помощью этого теста можно охарактеризовать размер и функцию предсердий и желудочков.
Уход
На временной ход и степень ремоделирования влияют многие факторы, включая тяжесть травмы, вторичные события (рецидивирующая ишемия или инфаркт), нейрогормональный активация, генетические факторы и экспрессия гена, и лечение. Лекарства могут ослабить ремоделирование. Ингибиторы ангиотензинпревращающего фермента (АПФ) последовательно показано снижение ремоделирования на животных моделях или при трансмуральном инфаркте и хронической перегрузке давлением. Клинические испытания показали, что терапия ингибиторами АПФ после инфаркта миокарда приводит к улучшению показателей миокарда, улучшению фракция выброса и снижение смертности по сравнению с пациентами, получавшими плацебо. Точно так же подавление альдостерон, прямо или косвенно, приводит к улучшению ремоделирования.[9] Карведилол, 3-го поколения бета-блокатор, может фактически обратить процесс ремоделирования за счет уменьшения объема левого желудочка и улучшения систолической функции.[10][11] Ранняя коррекция врожденных пороков сердца, если это необходимо, может предотвратить ремоделирование, как и лечение хронических гипертония или же порок клапанов сердца. Часто также наблюдается обратное ремоделирование или улучшение функции левого желудочка.[нужна цитата ]
Смотрите также
Рекомендации
- ^ Mihl, C .; Dassen, W. R. M .; Койперс, Х. (2008). «Ремоделирование сердца: концентрическая гипертрофия в сравнении с эксцентрической у силовых и выносливых спортсменов». Нидерланды Heart Journal. 16 (4): 129–33. Дои:10.1007 / BF03086131. ЧВК 2300466. PMID 18427637.
- ^ Желудочковый + ремоделирование в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- ^ Ю, Чеук-Ман; Бликер, Гейб Б.; Фунг, Джеффри Винг-Хонг; Schalij, Martin J .; Чжан, Цин; Валл, Эрнст Э. ван дер; Чан, Ят-Сун; Конг, Шунь-Линг; Бакс, Джерун Дж. (13 сентября 2005 г.). «Обратное ремоделирование левого желудочка, но не клиническое улучшение, предсказывает долгосрочное выживание после сердечной ресинхронизирующей терапии». Тираж. 112 (11): 1580–86. Дои:10.1161 / cycleaha.105.538272. ISSN 0009-7322. PMID 16144994.
- ^ Ипенбург, Клаудиа; Боммел, Рутгер Дж. Ван; Борлеффс, К. Ян Виллем; Бликер, Гейб Б.; Боерсма, Эрик; Schalij, Martin J .; Бакс, Джерун Дж. (2009). «Долгосрочный прогноз после сердечной ресинхронизирующей терапии связан со степенью обратного ремоделирования левого желудочка при промежуточном наблюдении». Журнал Американского колледжа кардиологии. 53 (6): 483–90. Дои:10.1016 / j.jacc.2008.10.032.
- ^ Сааведра, В. Федерико; Тунин, Ричард С; Паолоччи, Назарено; Мисима, Такаяки; Судзуки, Джордж; Эмала, Чарльз В; Chaudhry, Pervaiz A; Анагностопулос, Петрос; Гупта, Рамеш C (2002). «Обратное ремоделирование и усиление адренергического резерва от пассивной внешней поддержки при экспериментальной дилатационной сердечной недостаточности». Журнал Американского колледжа кардиологии. 39 (12): 2069–76. Дои:10.1016 / s0735-1097 (02) 01890-9.
- ^ Кац, Дэниел Х .; Бойссинк, Лорен; Зауэр, Эндрю Дж .; Фрид, Бенджамин Х .; Берк, Майкл А .; Шах, Санджив Дж. (2013). «Распространенность, клинические характеристики и исходы, связанные с эксцентрической и концентрической гипертрофией левого желудочка при сердечной недостаточности с сохранением фракции выброса». Американский журнал кардиологии. 112 (8): 1158–64. Дои:10.1016 / j.amjcard.2013.05.061. ЧВК 3788852. PMID 23810323.
- ^ а б c d е Кон, Джей Н.; Colucci, Wilson S; Ён, Сьюзан Б. «Ремоделирование сердца: основные аспекты». UpToDate.com. Получено 8 ноября 2017.
- ^ а б c d Азеведо, Паула С.; Полегато, Берта Ф; Миникуччи, Маркос Ф (январь 2016 г.). «Ремоделирование сердца: концепции, клиническое воздействие, патофизиологические механизмы и фармакологическое лечение». Arquivos Brasileiros de Cardiologia. 106 (1): 62–69. Дои:10.5935 / abc.20160005. ЧВК 4728597. PMID 26647721.
- ^ Питт, Бертрам; Ремме, Виллем; Заннад, Файез; Нитон, Джеймс; Мартинес, Фелипе; Роникер, Барбара; Биттман, Ричард; Херли, Стив; Клейман, Джей; Гатлин, Марджори (2003). «Эплеренон, селективный блокатор альдостерона, у пациентов с дисфункцией левого желудочка после инфаркта миокарда». Медицинский журнал Новой Англии. 348 (14): 1309–21. Дои:10.1056 / NEJMoa030207. PMID 12668699.
- ^ Хаттар, Р. С. (2003). «Влияние ингибиторов АПФ и бета-блокаторов на ремоделирование левого желудочка при хронической сердечной недостаточности». Минерва Кардиоангиологическая. 51 (2): 143–54. PMID 12783070.
- ^ Рейс Филью-младший, Кардосо-младший, Кардосо К.М., Перейра-Барретто А.С. (2015). «Обратное ремоделирование сердца: показатель лучшего прогноза сердечной недостаточности». Arquivos Brasileiros de Cardiologia. 104 (6): 502–06. Дои:10.5935 / abc.20150025. ЧВК 4484683. PMID 26131706.CS1 maint: несколько имен: список авторов (связь)
дальнейшее чтение
- «Ремоделирование левого желудочка при сердечной недостаточности: современные концепции клинической значимости и оценки». imaging.onlinejacc.org. Получено 2016-02-12.
