Аминоацилаза - Aminoacylase
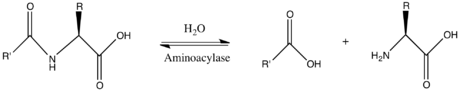
В энзимология, аминоацилаза (EC 3.5.1.14 ) является фермент который катализирует то химическая реакция
Таким образом, два субстраты этого фермента N-ацил-L-аминокислота и ЧАС2О, а его два товары находятся карбоксилат и L-аминокислота.
Этот фермент принадлежит к семье гидролазы, те, кто действует углерод-азотные связи Кроме как пептидные связи, в частности в линейных амиды. В систематическое название этого фермент класс N-ацил-L-аминокислота амидогидролаза. Другие широко используемые имена включают дегидропептидаза II, гистозим, гиппуриказа, бензамидаза, ацилаза I, гиппураза, амидовокислотная деацилаза, L-аминоацилаза, ацилаза, аминоацилаза I, L-аминокислота ацилаза, альфа-N-ациламиновая кислота гидролаза, длинная ациламидоацилаза, и короткая ациламидоацилаза. Этот фермент участвует в цикл мочевины и метаболизм аминогрупп.
Структура фермента

По состоянию на конец 2007 г. структуры были решены для этого класса ферменты, с PDB коды доступа 1Q7L и 1YSJ. Эти структуры также соответствуют двум известным первичные аминокислотные последовательности за аминоацилазы. В связанных документах выделяются два типа домены содержащие аминоацилазы: Цинк связывающие домены - которые связывают Zn2+ ионы - и домены что облегчает димеризация из Цинк связывающие домены.[1][2] Это это димеризация это позволяет катализ происходить, поскольку аминоацилазы активный сайт лежит между двумя Цинк привязка домены.[1]
Граница Цинк способствует привязка из N-ацил-L-аминокислота субстрат, вызывая конформационный сдвиг это приносит протеин подразделения вместе вокруг субстрат и позволяя катализ происходить.[3] Аминоацилаза 1 существует в гетеротетрамерный структура, то есть 2 Цинк связывающие домены и 2 димеризация домены собраться вместе, чтобы сделать аминоацилаза 1 с четвертичная структура.
Ферментный механизм
Аминоацилаза - это металлофермент это нужно Цинк (Zn2+ ) как кофактор функционировать.[3][4] В Цинк ионы внутри аминоацилазы каждый координирован гистидин, глутамат, аспартат, и воды.[1][3][5] В Цинк ион поляризует то воды, облегчая ее депротонирование рядом базовый остаток.[3][5] Отрицательно заряженный гидроксид-ион является нуклеофильный и атакует электрофильный карбонил углерод из субстрат ацильная группа.[5] Точный механизм после этого момента неизвестно, с одной возможностью, что карбонил затем преобразовывается, нарушает амидная связь, и образует два товары. В какой-то момент в механизм, еще один воды молекула входит и координаты с Цинк, возвращая фермент в исходное состояние.[5]
Нуклеофильная атака водой является лимитирующей стадией аминоацилазы. каталитический механизм.[6] Этот нуклеофильная атака обратима, а последующие шаги быстрые и необратимые.[6] Эта последовательность реакций является примером Кинетика Михаэлиса – Ментен, позволяющий определить KM, KКот, VМаксимум, номер оборота, и субстратная специфичность через классический Михаэлис-Ментен фермент эксперименты.[6] Второй и третий шаги вперед вызывают образование и высвобождение реакции товары.[6]
Биологическая функция

Аминоацилазы экспрессируются в почка, где они перерабатывают N-ацил-L-аминокислоты в качестве L-аминокислоты и помощь в регулировании цикла мочевины.
N-ацил-L-аминокислоты формируются, когда L-аминокислоты иметь их N-конец ковалентно связанный для ацильная группа. В ацильная группа обеспечивает стабильность аминокислота, что делает его более устойчивым к деградации. Кроме того, N-ацил-L-аминокислоты не могут использоваться непосредственно в качестве строительных блоков для белки и сначала должен быть преобразован в L-аминокислоты аминоацилазой. Опять же, L-аминокислота продукты можно использовать для биосинтез или катаболизируется энергия.
Аминоацилаза участвует в регулирование из цикл мочевины. N-ацетил-L-глутамат является аллостерический активатор из карбамоилфосфатсинтетаза, важный фермент который совершает NH4+ молекулы к цикл мочевины.[7] Цикл мочевины избавляет от избытка аммиак (NH4+ ) в организме, процесс, который необходимо активировать в периоды повышенной катаболизм белков, так как аминокислота поломка производит большое количество NH4+.[7] Когда катаболизм аминокислот увеличивается, N-ацетилглутаматсинтаза активируется, продуцируя больше N-ацетил-L-глутамата, который активирует карбамоилфосфатсинтетаза и позволяет избавиться от лишнего NH4+ из катаболизм.[7]
Аминоацилаза активируется во время дефицита питательных веществ или голодание, вызывая N-ацетил-L-глутамат поломка, которая понижает регулирование карбамоилфосфатсинтетаза и остальные цикл мочевины. Этот ответ эволюционно выгоден, поскольку дефицит питательных веществ означает, что их не так много. NH4+ от которого необходимо избавиться, и поскольку организм хочет сохранить как можно больше аминокислот.[7]
Актуальность болезни
Дефицит аминоацилазы 1 (A1D ) является редким болезнь вызвано аутосомно-рецессивный мутация в аминоацилаза 1 ген (ACY1 ) на хромосома 3p21.[8][9][10][11][12] Отсутствие функционала аминоацилаза 1 вызванный A1D приводит к дисфункциональной цикл мочевины, вызывая массив неврологические расстройства включая припадки, мускулистый гипотония, умственная отсталость, и нарушение психомоторного развития.[8][13][14][15] A1D также был связан с аутизм .[16] Пациенты с A1D часто начинают проявлять симптомы вскоре после рождение но, похоже, полностью выздоровеет в ближайшие несколько лет.[13][14][15]
Дефицит аминоацилазы 2 - также известный как Болезнь Канавана - Другой редкое заболевание вызвано мутация в Ген ASPA (на хромосома 17 ), что приводит к дефициту фермент аминоацилаза 2. Аминоацилаза 2 известен тем, что может гидролизовать N-ацетиласпартат пока аминоацилаза 1 не можешь.[17]
Промышленная значимость
Аминоацилазы использовались для производства L-аминокислоты в промышленные установки с конца 1950-х гг.[18] Поскольку аминоацилазы являются субстрат специфический для N-ацил-L-аминокислоты и нет N-ацил-D-аминокислоты аминоацилазы можно использовать для надежного приема смесь из этих двух реагенты и только конвертировать L энантиомеры в товары - которые затем могут быть изолированы растворимость из непрореагировавших N-ацил-D-аминокислоты.[18][19] Пока это процесс было сделано в реактор периодического действия на много лет более быстрый и менее расточительный процесс был разработан в конце 1970-х годов и помещал аминоацилазы в столбец что N-ацил -аминокислоты затем непрерывно промывались.[18][20] Этот процесс все еще используется в промышленные установки сегодня конвертировать N-ациламинокислоты к аминокислоты в энантиомерно конкретным образом.
Эволюция
Много научные исследования на протяжении последней половины век использовали аминоацилазу свиньи в качестве модели аминоацилазы фермент.[21] В аминокислота последовательность и первичная структура аминоацилазы свиней.[4] Свиной аминоацилаза 1 состоит из двух одинаковых гетеродимерный субъединицы, каждая из которых состоит из 406 аминокислот, с ацетилаланин на N-конце каждого.[4] Свиной аминоацилаза отличается от человек аминоацилаза в структура но повторяет его функцию.[1][4][22] Из этих данных можно сделать вывод, что эти два ферменты произошли от общих предков белок, сохраняя функцию, но расходясь структура через некоторое время.[1][4]
Рекомендации
- ^ а б c d е Линднер Х.А., Лунин В.В., Алари А., Хеккер Р., Сиглер М., Менар Р. (ноябрь 2003 г.). «Важные роли лигирования цинка и димеризации ферментов для катализа в семействе аминоацилазы-1 / M20». Журнал биологической химии. 278 (45): 44496–504. Дои:10.1074 / jbc.M304233200. PMID 12933810.
- ^ Fones WS, Lee M (апрель 1953 г.). «Гидролиз N-ацильных производных аланина и фенилаланина ацилазой I и карбоксипептидазой». Журнал биологической химии. 201 (2): 847–56. PMID 13061423.
- ^ а б c d Линднер Х.А., Алари А., Уилке М., Сулеа Т. (апрель 2008 г.). «Исследование ацил-связывающего кармана аминоацилазы-1». Биохимия. 47 (14): 4266–75. Дои:10.1021 / bi702156h. PMID 18341290.
- ^ а б c d е Митта М., Охноги Х., Ямамото А., Като И., Сакияма Ф., Цунасава С. (декабрь 1992 г.). «Первичная структура аминоацилазы 1 свиньи, выведенная из последовательности кДНК». Журнал биохимии. 112 (6): 737–42. Дои:10.1093 / oxfordjournals.jbchem.a123968. PMID 1284246.
- ^ а б c d Hernick M, Fierke CA (январь 2005 г.). «Гидролазы цинка: механизмы цинк-зависимых деацетилаз». Архивы биохимии и биофизики. 433 (1): 71–84. Дои:10.1016 / j.abb.2004.08.006. PMID 15581567.
- ^ а б c d Отвош Л., Моравчик Э., Мади Г. (сентябрь 1971 г.). «Исследование механизма катализируемого ацилазой-I гидролиза ациламинокислоты». Сообщения о биохимических и биофизических исследованиях. 44 (5): 1056–64. Дои:10.1016 / S0006-291X (71) 80192-4. PMID 5160398.
- ^ а б c d Берг, Джереми М .; Тимочко, Джон Л .; Страйер, Люберт (2012). Биохимия. Нью-Йорк: В. Х. Фриман и компания. п. 688. ISBN 978-1-4292-2936-4.
- ^ а б Соммер А., Кристенсен Э., Швенгер С. и др. (Июнь 2011 г.). «Молекулярные основы дефицита аминоацилазы 1» (PDF). Biochimica et Biophysica Acta (BBA) - Молекулярная основа болезни. 1812 (6): 685–90. Дои:10.1016 / j.bbadis.2011.03.005. PMID 21414403.
- ^ Ферри Л., Фунгини С., Фиораванти А. и др. (Октябрь 2013). «Дефицит аминоацилазы I из-за пропуска экзона мРНК ACY1». Клиническая генетика. 86 (4): 367–372. Дои:10.1111 / cge.12297. PMID 24117009. S2CID 24017306.
- ^ Миллер Ю.Е., Минна Д.Д., Газдар А.Ф. (июнь 1989 г.). «Отсутствие экспрессии аминоацилазы-1 при мелкоклеточном раке легкого. Доказательства инактивации генов, кодируемых хромосомой 3р». Журнал клинических исследований. 83 (6): 2120–4. Дои:10.1172 / JCI114125. ЧВК 303939. PMID 2542383.
- ^ EntrezGene 95
- ^ Миллер Ю.Е., Драбкин Х., Джонс С., Фишер Дж. Х. (сентябрь 1990 г.). «Аминоацилаза-1 человека: клонирование, региональное отнесение к дистальной хромосоме 3p21.1 и идентификация перекрестно гибридизирующейся последовательности на хромосоме 18». Геномика. 8 (1): 149–54. Дои:10.1016 / 0888-7543 (90) 90237-О. PMID 1707030.
- ^ а б Sass JO, Mohr V, Olbrich H, et al. (Март 2006 г.). «Мутации в ACY1, гене, кодирующем аминоацилазу 1, вызывают новую врожденную ошибку метаболизма». Американский журнал генетики человека. 78 (3): 401–9. Дои:10.1086/500563. ЧВК 1380284. PMID 16465618.
- ^ а б Sass JO, Olbrich H, Mohr V и др. (Июнь 2007 г.). «Неврологические находки при дефиците аминоацилазы 1». Неврология. 68 (24): 2151–3. Дои:10.1212 / 01.wnl.0000264933.56204.e8. PMID 17562838. S2CID 43376960.
- ^ а б Ван Костер Р.Н., Герло Е.А., Джардина Т.Г. и др. (Декабрь 2005 г.). «Дефицит аминоацилазы I: новая врожденная ошибка метаболизма». Сообщения о биохимических и биофизических исследованиях. 338 (3): 1322–6. Дои:10.1016 / j.bbrc.2005.10.126. PMID 16274666.
- ^ Тылки-Шиманска А., Градовска В., Соммер А. и др. (Декабрь 2010 г.). «Дефицит аминоацилазы 1, связанный с аутичным поведением». Журнал наследственных метаболических заболеваний. 33 Дополнение 3: S211–4. Дои:10.1007 / s10545-010-9089-3. PMID 20480396. S2CID 13374954.
- ^ Се Цюй, Го Т, Ван Т, Лу Дж, Чжоу Х.М. (ноябрь 2003 г.). «Индуцированная аспартатом укладка аминоацилазы и формирование расплавленной глобулы». Международный журнал биохимии и клеточной биологии. 35 (11): 1558–72. Дои:10.1016 / S1357-2725 (03) 00131-6. PMID 12824065.
- ^ а б c Сато, Тадаши; Тоса, Тэцуя (2010). «Производство L-аминокислот аминоацилазой». Энциклопедия промышленной биотехнологии. С. 1–20. Дои:10.1002 / 9780470054581.eib497. ISBN 978-0-470-05458-1.
- ^ Бирнбаум С.М., Левинтов Л., Кингсли Р. Б., Гринштейн Дж. П. (январь 1952 г.). «Специфичность аминокислотных ацилаз». Журнал биологической химии. 194 (1): 455–70. PMID 14927637.
- ^ Хуан М.К., Чжоу Х.М. (1994). «Щелочное разворачивание и солевое сворачивание аминоацилазы при высоком pH». Ферменты и протеины. 48 (4): 229–37. Дои:10.1159/000474993. PMID 8821711.
- ^ Кореиси М., Асаяма Ф., Иманака Х. и др. (Октябрь 2005 г.). «Очистка и характеристика новой аминоацилазы из Streptomyces mobaraensis». Биология, биотехнология и биохимия. 69 (10): 1914–22. Дои:10.1271 / bbb.69.1914. PMID 16244442.
- ^ Митта М., Като И., Цунасава С. (август 1993 г.). «Нуклеотидная последовательность аминоацилазы-1 человека». Biochimica et Biophysica Acta (BBA) - Структура и экспрессия гена. 1174 (2): 201–3. Дои:10.1016 / 0167-4781 (93) 90116-У. PMID 8357837.