Фисетин - Fisetin
 | |
 | |
| Имена | |
|---|---|
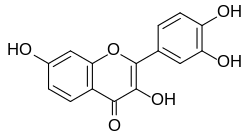
| Название ИЮПАК 2- (3,4-дигидроксифенил) -3,7-дигидроксихромен-4-он | |
| Другие имена Котинин (не путать с Котинин ) 5-дезоксикверцетин Superfustel Fisetholz Фиетин Fustel Fustet Viset Юнгер Фустик | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard | 100.007.669 |
| КЕГГ | |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C15ЧАС10О6 | |
| Молярная масса | 286,2363 г / моль |
| Плотность | 1,688 г / мл |
| Температура плавления | 330 ° С (626 ° F, 603 К) |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Фисетин (7,3′,4′-флавон-3-ол ) это растение флавонол от флавоноид группа полифенолы.[1] Его можно найти во многих растениях, где он служит красителем. Он также содержится во многих фруктах и овощах, таких как клубника, яблоки, хурма, лук и огурцы.[2] Его химическая формула была впервые описана австрийским химиком. Йозеф Герциг в 1891 г.[3]
В биологическая активность физетина были изучены во многих лабораторных исследованиях; как и другие полифенолы у него много занятий.
Биологические источники
Фисетин можно найти в самых разных растениях. Он находится в Eudicotyledons, например деревья и кустарники в семье Fabaceae, например, акации Acacia greggii[4] и Акация берландиери,[4] попугайное дерево (Butea frondosa ), медовая саранча (Gleditsia triacanthos ), члены семьи Anacardiaceae такой как Quebracho Colorado и виды рода Rhus, который содержит сумахи.[5] Вместе с мирицетин, физетин обеспечивает цвет традиционного желтого красителя молодой фустик, который был извлечен из Евразийское дымное дерево (Rhus cotinus). Многие фрукты и овощи также содержат физетин,[6] включая клубника[7][8] яблоки[8] и виноград.[8][9] Физетин может быть извлечен из фруктов и трав в соках, вина,[10] и настои, такие как чаи.[9] Он также встречается в Однодольные Такие как лук.[8] Он также присутствует в Pinophyta такие виды, как желтый кипарис (Callitropsis nootkatensis).
| Источник растения[8] | Количество Фисетина (мкг / г) |
|---|---|
| клубника | 160 |
| яблоко | 26 |
| Хурма | 10.6 |
| Лук | 4.8 |
| Корень лотоса | 5.8 |
| Виноград | 3.9 |
| Киви | 2.0 |
| Персик | 0.6 |
| Огурец | 0.1 |
| Помидор | 0.1 |
Биосинтез
Фисетин - это флавоноид, что является полифенол подгруппа.[1] Синтез флавоноидов начинается с фенилпропаноид путь, в котором фенилаланин, аминокислота, превращается в 4-кумароил-КоА. Это соединение, которое вступает в путь биосинтеза флавоноидов. Халкон-синтаза, первый фермент этого пути, производит халкон из 4-кумароил-КоА. Все флавоноиды являются производными этого халькона (это семейство так называемых халконоиды ). Активность различных ферментов, включая изомеразы и гидроксилазы, изменяет основную цепь в зависимости от подкласса производимого флавоноида. Трансферазы помогают контролировать изменения растворимости и реакционной способности флавоноидов, катализируя добавление таких веществ, как метильные группы и сахара. Это позволяет контролировать колебания физиологической активности.[11]
Регуляция гена биосинтеза флавоноидов происходит за счет взаимодействия различных факторов транскрипции. В зависимости от комбинации взаимодействий факторов транскрипции структурные гены, участвующие в биосинтезе флавоноидов, экспрессируются в определенных местах растения и в определенное время. Многие факторы транскрипции миелобластоза (MYB) были идентифицированы в различных фруктах и растениях, включая клубнику, кукурузу и арабидопсис, как важные для регуляции биосинтеза и накопления флавоноидов. Эти факторы транскрипции продолжают изучаться на модельных растительных организмах, таких как кукуруза и арабидопсис.[11]
Также было показано, что окружающая среда растения влияет на путь биосинтеза флавоноидов. Более короткие длины волн света, от синего до ультрафиолетового, позволяют увеличить производство и накопление флавоноидов во фруктах. Эти длины волн активируют ферменты, которые участвуют в путях биосинтеза фенилпропаноидов и флавоноидов, стимулируя выработку флавоноидов. Уровень стимуляции может варьироваться для разных фруктов.[12]
Клиническое значение
Фисетин, как и другие полифенолы Такие как ресвератрол, это сиртуин-активирующее соединение [13] и в лабораторных исследованиях было показано, что он продлевает жизнь дрожжам, червям, мухам и мышам.[14][15] Как и другие соединения, он также продемонстрировал свою реактивность во многих различных анализах биологической активности, что повышает вероятность того, что любое лекарство, полученное из физетина, будет иметь слишком много побочных эффектов, чтобы быть полезным.[14][16]
Фисетин показал противораковую активность в исследованиях на клетках и модельных животных, проведенных в лабораториях, и, по-видимому, блокирует Путь PI3K / AKT / mTOR,[17] наряду с другими механизмами побудить апоптоз активации и предотвращения устойчивости к апоптозу.[18]
В лабораторных исследованиях также было показано, что антипролиферативный агент, вмешиваясь в клеточный цикл несколькими способами.[19] Фисетин, как и некоторые другие флавоноиды, было обнаружено в лабораторных исследованиях, чтобы быть ингибитор топоизомеразы, которые могут оказаться канцерогенными или противораковыми - необходимы дальнейшие исследования.[20]
Было доказано, что фисетин является эффективным сенолитический агент у мышей дикого типа, с эффектами увеличения продолжительности жизни, снижением маркеров старения в тканях и уменьшением возрастных патологий.[21] Исследования культур клеток стареющих эндотелиальные клетки пупочной вены человека показали, что физетин вызывает апоптоз путем ингибирования антиапоптотического белка Bcl-xL.[22] Фисетин имеет примерно вдвое большую сенолитическую активность, чем кверцетин.[23] По состоянию на октябрь 2018 года в США в настоящее время проводятся клинические испытания, демонстрирующие эффективность на людях.[24]
В исследованиях, проведенных на клетках в лаборатории, физетин подавляет активность нескольких провоспалительных цитокины, включая фактор некроза опухоли альфа, интерлейкин 6, и ядерный фактор каппа B (NF-κB).[19] Противовоспалительное действие обусловлено деацилирование провоспалительного фактор транскрипции NF-κB - пользователем сиртуин 1.[25]
Лабораторные исследования также показали, что он повышает регуляцию глутатион, эндогенный антиоксидант.[19][26] Фисетин также имеет прямую активность как Восстановитель, химически реагирующий с активные формы кислорода чтобы нейтрализовать их.[26] На основании лабораторных исследований установлено, что физетин оседает в клеточные мембраны и предотвращает окислительное повреждение липиды в клеточной мембране.[26] Физетин, как и другие флавоноиды, имеет плоскую структуру с множеством углеродных колец. Физетин способен улавливать свободные радикалы в результате своей электронодонорной способности, что связано с наличием двух гидроксил группы на одном кольце и гидроксильная группа на другом кольце.[26]
Скрининг in vitro выявил физетин как антимитотик сложный.[27]
Рекомендации
- ^ а б Родригес-Гарсия К., Санчес-Кесада С., Гафорио Дж. Дж. (2019). «Диетические флавоноиды как химиопрофилактические средства против рака: обновленный обзор исследований на людях». Питательные вещества. 18 (5): 137. Дои:10.3390 / antiox8050137. ЧВК 6562590. PMID 31109072.
- ^ Саху, Бидья Дхар; Калвала, Анил Кумар; Конеру, Мегана; Кумар, Джеральд Махеш; Кунча, Мадхусудана; Рачамалла, Шьям Сандер; Систла, Рамакришна (3 сентября 2014 г.). «Улучшающий эффект физетина на индуцированную цисплатином нефротоксичность у крыс посредством модуляции активации NF-κB и антиоксидантной защиты». PLOS ONE. 9 (9): e105070. Bibcode:2014PLoSO ... 9j5070S. Дои:10.1371 / journal.pone.0105070. ЧВК 4153571. PMID 25184746.
- ^ Герциг, Дж. (1891). "Studien über Quercetin und seine Derivate, VII. Abhandlung" [Исследования кверцетина и его производных, трактат VII]. Monatshefte für Chemie (на немецком). 12 (1): 177–90. Дои:10.1007 / BF01538594. S2CID 197766725.
- ^ а б Forbes TDA, Клемент Б.А. "Химия акации из Южного Техаса" (PDF). Техасский центр сельскохозяйственных исследований и распространения знаний A&M at. Архивировано из оригинал (PDF) 15 мая 2011 г.. Получено 2010-04-14.
- ^ Gábor, M .; Eperjessy, E. (1966). «Антибактериальный эффект физетина и физетинидина». Природа. 212 (5067): 1273. Bibcode:1966Натура.212.1273Г. Дои:10.1038 / 2121273a0. PMID 21090477. S2CID 4262402.
- ^ Fiorani, M .; Аккорси, А. (2005). «Диетические флавоноиды как внутриклеточные субстраты для транс-плазматической активности оксидоредуктазы эритроцитов». Британский журнал питания. 94 (3): 338–345. Дои:10.1079 / bjn20051504. PMID 16176603.
- ^ Махер, Памела; Даргуш, Ричард; Эрен, Дженнифер Л .; Окада, Шиничи; Шарма, Кумар; Шуберт, Дэвид (2011). Дели, Мария А. (ред.). «Физетин снижает гликирование метилглиоксаль-зависимого белка и ограничивает осложнения диабета». PLOS ONE. 6 (6): e21226. Bibcode:2011PLoSO ... 621226M. Дои:10.1371 / journal.pone.0021226. ЧВК 3124487. PMID 21738623. Сложить резюме – ScienceDaily (28 июня 2011 г.).
- ^ а б c d е Arai, Y .; Watanabe, S .; Кимира, М .; Shimoi, K .; Mochizuki, R .; Кинаэ, Н. (2000). «Потребление с пищей флавонолов, флавонов и изофлавонов японскими женщинами и обратная корреляция между потреблением кверцетина и концентрацией холестерина ЛПНП в плазме». Журнал питания. 130 (9): 2243–2250. Дои:10.1093 / jn / 130.9.2243. PMID 10958819.
- ^ а б Виньяс, П .; Martínez-Castillo, N .; Campillo, N .; Эрнандес-Кордова, М. (2011). «Микроэкстракция капель с прямым взвешиванием с дериватизацией в порте для инъекций в сочетании с газовой хроматографией – масс-спектрометрией для анализа полифенолов в травяных настоях, фруктах и функциональных пищевых продуктах». Журнал хроматографии А. 1218 (5): 639–646. Дои:10.1016 / j.chroma.2010.12.026. PMID 21185565.
- ^ De Santi, C .; Pietrabissa, A .; Моска, Ф .; Пасифици, Г. М. (2002). «Метилирование кверцетина и физетина, флавоноидов, широко распространенных в съедобных овощах, фруктах и вине, печенью человека». Международный журнал клинической фармакологии и терапии. 40 (5): 207–212. Дои:10.5414 / cpp40207. PMID 12051572.
- ^ а б Ferreyra, M.L .; Rius, S.P .; Касати, П. (28 сентября 2012 г.). «Флаваноиды: биосинтез, биологические функции и биотехнологические применения». Границы науки о растениях. 3 (222): 222. Дои:10.3389 / fpls.2012.00222. ЧВК 3460232. PMID 23060891.
- ^ Zoratti, L .; Карппинен, К .; Эскобар, A.L .; Haggman, H .; Яакола, Л. (9 октября 2014 г.). «Светоуправляемый биосинтез флаваноидов во фруктах». Границы науки о растениях. 5 (534): 534. Дои:10.3389 / fpls.2014.00534. ЧВК 4191440. PMID 25346743.
- ^ Хван ES, Сон SB (2017). «Никотинамид является ингибитором SIRT1 in vitro, но может быть стимулятором в клетках». Клеточные и молекулярные науки о жизни. 74 (18): 3347–3362. Дои:10.1007 / s00018-017-2527-8. PMID 28417163. S2CID 25896400.
- ^ а б Баур, Дж. А. (август 2010 г.). «Биохимические эффекты активаторов SIRT1». Biochimica et Biophysica Acta (BBA) - Белки и протеомика. 1804 (8): 1626–34. Дои:10.1016 / j.bbapap.2009.10.025. ЧВК 2886178. PMID 19897059.
- ^ Юсефзаде, Мэтью Дж .; Чжу, Йи; Макгоуэн, Сара Дж .; Анджелини, Луиза; Fuhrmann-Stroissnigg, Heike; Сюй, Мин; Линь, юань юань; Мелос, Кендра I .; Пирцхалава, Тамар; Инман, Кристина Л .; Макгукиан, Коллин (01.10.2018). «Фисетин - сенотерапевтическое средство, продлевающее здоровье и продолжительность жизни». EBioMedicine. 36: 18–28. Дои:10.1016 / j.ebiom.2018.09.015. ISSN 2352-3964. ЧВК 6197652. PMID 30279143.
- ^ Кроон, Пенсильвания; Клиффорд, Миннесота; Крозье, А; и другие. (Июль 2004 г.). «Как мы должны оценивать эффекты воздействия пищевых полифенолов in vitro?». Являюсь. J. Clin. Нутр. 80 (1): 15–21. Дои:10.1093 / ajcn / 80.1.15. PMID 15213022.
- ^ Сайед, DN; и другие. (Сентябрь 2013 г.). «Ингибирование передачи сигналов Akt / mTOR диетическим флавоноидом физетином». Противораковые агенты Med Chem. 13 (7): 995–1001. Дои:10.2174/18715206113139990129. ЧВК 3985520. PMID 23293889.
- ^ Кашьяп Д., Гарг В.К., Тули Х.С., Сандху С. (2019). «Физетин и кверцетин: многообещающие флавоноиды с химиопрофилактическим потенциалом». Биомолекулы. 9 (5): 174. Дои:10.3390 / biom9050174. ЧВК 6572624. PMID 31064104.
- ^ а б c Гупта, Южная Каролина; и другие. (1 октября 2014 г.). «Снижение регуляции фактора некроза опухоли и других провоспалительных биомаркеров полифенолами». Архивы биохимии и биофизики. 559: 91–9. Дои:10.1016 / j.abb.2014.06.006. PMID 24946050.
- ^ Салерно, С .; Da Settimo, F .; Taliani, S .; Simorini, F .; La Motta, C .; Fornaciari, G .; Марини, А. М. (2010). «Последние достижения в разработке двойных ингибиторов топоизомеразы I и II в качестве противораковых препаратов». Curr Med Chem. 17 (35): 4270–90. Дои:10.2174/092986710793361252. PMID 20939813.
- ^ Юсефзаде, Мэтью Дж .; Чжу, Йи; Макгоуэн, Сара Дж .; Анджелини, Луиза; Fuhrmann-Stroissnigg, Heike; Сюй, Мин; Линь, юань юань; Мелос, Кендра I .; Пирцхалава, Тамар (29.09.2018). «Фисетин - сенотерапевтическое средство, продлевающее здоровье и продолжительность жизни». EBioMedicine. 36: 18–28. Дои:10.1016 / j.ebiom.2018.09.015. ISSN 2352-3964. ЧВК 6197652. PMID 30279143.
- ^ Киркланд JL, Tchkonia T (2020). «Сенолитические препараты: от открытия до перевода». Журнал внутренней медицины. 288 (5): 518–536. Дои:10.1111 / joim.13141. ЧВК 7405395. PMID 32686219.
- ^ Вильд Л., Беллантуоно И., Чкония Т., Дэнсон С., Киркланд Д. Л. (2020). «Старение и рак: обзор клинических последствий старения и сенотерапии». Рак. 12 (8): e2134. Дои:10.3390 / раки12082134. ЧВК 7464619. PMID 32752135.
- ^ «Снятие физетином дряхлости, воспаления и сопутствующие меры у пожилых женщин - полный текст - ClinicalTrials.gov». Получено 2018-10-12.
- ^ Исид С, Скафуро М, Неббиозо А, Альтуччи Л. (2020). «Активация SIRT1 натуральными фитохимическими веществами: обзор». Границы фармакологии. 11: 1225. Дои:10.3389 / fphar.2020.01225. ЧВК 7426493. PMID 32848804.
- ^ а б c d Хан, N; Сайед, DN; Ахмад, N; Mukhtar, H (июль 2013 г.). «Физетин: диетический антиоксидант для укрепления здоровья». Антиоксиданты и редокс-сигналы. 19 (2): 151–62. Дои:10.1089 / ars.2012.4901. ЧВК 3689181. PMID 23121441.
- ^ Салмела, Анна-Лина; Pouwels, Jeroen; Варис, Аста; Кукконен, Ану М .; Тойвонен, Паулина; Halonen, Pasi K .; Перяля, Мерья; Каллиониеми, Олли; Горбский, Гэри Дж .; Каллио, Марко Дж. (2009). «Диетический флавоноид физетин вызывает принудительный выход из митоза, воздействуя на контрольную точку митотического веретена». Канцерогенез. 30 (6): 1032–1040. Дои:10.1093 / carcin / bgp101. ЧВК 2691139. PMID 19395653.
