Флавоны - Flavones

Флавоны (от латинский Flavus «желтый») относятся к классу флавоноиды на основе основной цепи 2-фенилхромен-4-она (2-фенил-1-бензопиран -4-one) (как показано на первом изображении этой статьи).[1][2]
Флавоны часто встречаются в продуктах питания, в основном из специи, красно-фиолетовые фрукты и овощи.[1] Общие флавоны включают: апигенин (4 ', 5,7-тригидроксифлавон), лютеолин (3 ', 4', 5,7-тетрагидроксифлавон), мандаритин (4 ', 5,6,7,8-пентаметоксифлавон), хризин (5,7-дигидроксифлавон) и 6-гидроксифлавон.[1]
Прием и устранение
Флавоны в основном содержатся в специях и красных или пурпурных растительных продуктах.[1] Расчетная суточная доза флавонов составляет около 2 мг в день.[1] Флавоны не прошли проверку физиологический эффекты в организме человека и нет антиоксидант пищевая ценность.[1][3] После проглатывания и метаболизм, флавоны, другие полифенолы и их метаболиты плохо всасываются в органах тела и быстро выводятся с моча, указывая на механизмы, влияющие на их предполагаемое отсутствие метаболических ролей в организме.[1][4]
Лекарственные взаимодействия
Флавоны влияют на CYP (P450 ) Мероприятия [5][6] которые являются ферментами, которые метаболизируют большинство лекарств в организме.
Органическая химия
В органическая химия Существует несколько методов синтеза флавонов:
- Реакция Аллана – Робинсона
- Синтез ауверса
- Перегруппировка Бейкера – Венкатарамана
- Реакция Алгара – Флинна – Оямады
Другой метод - дегидративная циклизация некоторых 1,3-диарилдикетонов.[7]

Перегруппировка Вессели-Мозера
В Перегруппировка Уэссели-Мозера (1930)[8] был важным инструментом в выяснении структуры флавоноидов. Он включает превращение 5,7,8-триметоксифлавона в 5,6,7-тригидроксифлавон при гидролизе метокси группы для фенол группы. Он также имеет синтетический потенциал, например:[9]
Эта реакция перегруппировки происходит в несколько этапов: А кольцо открывается в дикетон, B ротация облигаций с образованием благоприятного ацетилацетон -подобное взаимодействие фенил-кетон и C гидролиз двух метоксигрупп и замыкание кольца.
Общие флавоны
| имя | Структура | р3 | р5 | р6 | р7 | р8 | р2' | р3' | р4' | р5' | р6' |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Основа флавонов | 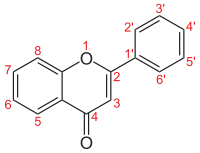 | – | – | – | – | – | – | – | – | – | – |
| Примулетин | – | -ОЙ | – | – | – | – | – | – | – | – | |
| Хрысин | – | -ОЙ | – | -ОЙ | – | – | – | – | – | – | |
| Тектохризин | – | -ОЙ | – | –OCH3 | – | – | – | – | – | – | |
| Приметин | – | -ОЙ | – | – | -ОЙ | – | – | – | – | – | |
| Апигенин | – | -ОЙ | – | -ОЙ | – | – | – | -ОЙ | – | – | |
| Акацетин | – | -ОЙ | – | -ОЙ | – | – | – | –OCH3 | – | – | |
| Генкванин | – | -ОЙ | – | –OCH3 | – | – | – | -ОЙ | – | – | |
| Эхиоидинин | – | -ОЙ | – | –OCH3 | – | -ОЙ | – | – | – | – | |
| Байкалеин | – | -ОЙ | -ОЙ | -ОЙ | – | – | – | – | – | – | |
| Ороксилон | – | -ОЙ | –OCH3 | -ОЙ | – | – | – | – | – | – | |
| Negletein | – | -ОЙ | -ОЙ | –OCH3 | – | – | – | – | – | – | |
| Норвогонин | – | -ОЙ | – | -ОЙ | -ОЙ | – | – | – | – | – | |
| Вогонин | – | -ОЙ | – | -ОЙ | –OCH3 | – | – | – | – | – | |
| Джеральдон | – | – | – | -ОЙ | – | – | –OCH3 | -ОЙ | – | – | |
| Титонин | – | – | – | –OCH3 | – | – | -ОЙ | –OCH3 | – | – | |
| Лютеолин | – | -ОЙ | – | -ОЙ | – | – | -ОЙ | -ОЙ | – | – | |
| 6-гидроксилютеолин | – | -ОЙ | -ОЙ | -ОЙ | – | – | -ОЙ | -ОЙ | – | – | |
| Хризоэриол | – | -ОЙ | – | -ОЙ | – | – | –OCH3 | -ОЙ | – | – | |
| Диосметин | – | -ОЙ | – | -ОЙ | – | – | -ОЙ | –OCH3 | – | – | |
| Pilloin | – | -ОЙ | – | –OCH3 | – | – | -ОЙ | –OCH3 | – | – | |
| Велютин | – | -ОЙ | – | –OCH3 | – | – | –OCH3 | -ОЙ | – | – | |
| Норартокарпетин | – | -ОЙ | – | -ОЙ | – | -ОЙ | – | -ОЙ | – | – | |
| Артокарпетин | – | -ОЙ | – | –OCH3 | – | -ОЙ | – | -ОЙ | – | – | |
| Scutellarein | – | -ОЙ | -ОЙ | -ОЙ | – | – | – | -ОЙ | – | – | |
| Hispidulin | – | -ОЙ | –OCH3 | -ОЙ | – | – | – | -ОЙ | – | – | |
| Сорбифолин | – | -ОЙ | -ОЙ | –OCH3 | – | – | – | -ОЙ | – | – | |
| Пектолинаригенин | – | -ОЙ | –OCH3 | -ОЙ | – | – | – | –OCH3 | – | – | |
| Цирсимаритин | – | -ОЙ | –OCH3 | –OCH3 | – | – | – | -ОЙ | – | – | |
| Миканин | – | -ОЙ | –OCH3 | –OCH3 | – | – | – | –OCH3 | – | – | |
| Isoscutellarein | – | -ОЙ | – | -ОЙ | -ОЙ | – | – | -ОЙ | – | – | |
| Запотинин | – | -ОЙ | –OCH3 | – | – | –OCH3 | – | – | – | –OCH3 | |
| Запотин | – | –OCH3 | –OCH3 | – | – | –OCH3 | – | – | – | –OCH3 | |
| Серрозиллин | – | –OCH3 | –OCH3 | – | – | – | –OCH3 | – | –OCH3 | – | |
| Алнетин | – | -ОЙ | –OCH3 | –OCH3 | –OCH3 | – | – | – | – | – | |
| Трицетин | – | -ОЙ | – | -ОЙ | – | – | -ОЙ | -ОЙ | -ОЙ | – | |
| Трицин | – | -ОЙ | – | -ОЙ | – | – | –OCH3 | -ОЙ | –OCH3 | – | |
| Коримбозин | – | -ОЙ | – | –OCH3 | – | – | –OCH3 | –OCH3 | –OCH3 | – | |
| Непетин | – | -ОЙ | –OCH3 | -ОЙ | – | – | -ОЙ | -ОЙ | – | – | |
| Педалитин | – | -ОЙ | -ОЙ | –OCH3 | – | – | -ОЙ | -ОЙ | – | – | |
| Нодифлоретин | – | -ОЙ | -ОЙ | -ОЙ | – | – | –OCH3 | -ОЙ | – | – | |
| Яцеозидин | – | -ОЙ | –OCH3 | -ОЙ | – | – | –OCH3 | -ОЙ | – | – | |
| Цирсилиол | – | -ОЙ | –OCH3 | –OCH3 | – | – | -ОЙ | -ОЙ | – | – | |
| Евпатилин | – | -ОЙ | –OCH3 | -ОЙ | – | – | –OCH3 | –OCH3 | – | – | |
| Цирсилинеол | – | -ОЙ | –OCH3 | –OCH3 | – | – | –OCH3 | -ОЙ | – | – | |
| Евпаторин | – | -ОЙ | –OCH3 | –OCH3 | – | – | – | –OCH3 | -ОЙ | – | |
| Синенсетин | – | –OCH3 | –OCH3 | –OCH3 | – | – | – | –OCH3 | –OCH3 | – | |
| Гиполаэтин | – | -ОЙ | – | -ОЙ | -ОЙ | – | -ОЙ | -ОЙ | – | – | |
| Онопордин | – | -ОЙ | – | -ОЙ | –OCH3 | – | -ОЙ | -ОЙ | – | – | |
| Wightin | – | -ОЙ | – | –OCH3 | –OCH3 | –OCH3 | -ОЙ | – | – | – | |
| Неваденсин | – | -ОЙ | –OCH3 | -ОЙ | –OCH3 | – | – | –OCH3 | – | – | |
| Ксантомикрол | – | -ОЙ | –OCH3 | –OCH3 | –OCH3 | – | – | -ОЙ | – | – | |
| Тангеретин | – | –OCH3 | –OCH3 | –OCH3 | –OCH3 | – | – | –OCH3 | – | – | |
| Серпиллин | – | -ОЙ | – | –OCH3 | –OCH3 | –OCH3 | –OCH3 | –OCH3 | – | – | |
| Судачитин | – | -ОЙ | –OCH3 | -ОЙ | –OCH3 | – | –OCH3 | -ОЙ | – | – | |
| Ацерозин | – | -ОЙ | –OCH3 | -ОЙ | –OCH3 | – | -ОЙ | –OCH3 | – | – | |
| Гименоксин | – | -ОЙ | –OCH3 | -ОЙ | –OCH3 | – | –OCH3 | –OCH3 | – | – | |
| Гарденин Д | – | -ОЙ | –OCH3 | –OCH3 | –OCH3 | – | -ОЙ | –OCH3 | – | – | |
| Нобилетин | – | –OCH3 | –OCH3 | –OCH3 | –OCH3 | – | –OCH3 | –OCH3 | – | – | |
| Скапозин | – | -ОЙ | –OCH3 | -ОЙ | –OCH3 | – | –OCH3 | –OCH3 | -ОЙ | ||
| имя | Структура | р3 | р5 | р6 | р7 | р8 | р2' | р3' | р4' | р5' | р6' |
использованная литература
- ^ а б c d е ж г «Флавоноиды». Информационный центр по микронутриентам, Институт Линуса Полинга, Университет штата Орегон, Корваллис, Орегон. Ноябрь 2015. Получено 30 марта 2018.
- ^ «Флавон». ChemSpider, Королевское химическое общество. 2015 г.. Получено 30 марта 2018.
- ^ Lotito, S; Фрей, Б. (2006). «Потребление продуктов, богатых флавоноидами, и увеличение антиоксидантной способности плазмы у людей: причина, следствие или эпифеномен?». Свободная радикальная биология и медицина. 41 (12): 1727–46. Дои:10.1016 / j.freeradbiomed.2006.04.033. PMID 17157175.
- ^ Дэвид Стаут (5 марта 2007 г.). «Исследования заставляют новый взгляд на биологию флавоноидов». EurekAlert !; По материалам пресс-релиза Университета штата Орегон.
- ^ Cermak R, Wolffram S., Потенциал флавоноидов влиять на метаболизм и фармакокинетику лекарств посредством местных желудочно-кишечных механизмов, Curr Drug Metab. 2006 Октябрь; 7 (7): 729-44.
- ^ Si D, Wang Y, Zhou YH и др. (Март 2009 г.). «Механизм ингибирования CYP2C9 флавонами и флавонолами». Drug Metab. Утилизация. 37 (3): 629–34. Дои:10.1124 / dmd.108.023416. PMID 19074529.[1]
- ^ Sarda SR, Pathan MY, Paike VV, Pachmase PR, Jadhav WN, Pawar RP (2006). «Простой синтез флавонов с использованием перерабатываемой ионной жидкости при микроволновом облучении» (PDF). Аркивок. xvi (16): 43–8. Дои:10.3998 / ark.5550190.0007.g05.[постоянная мертвая ссылка ]
- ^ Уэссели Ф., Мозер Г. Х. (декабрь 1930 г.). "Synthese und Konstitution des Skutellareins". Monatshefte für Chemie. 56 (1): 97–105. Дои:10.1007 / BF02716040.
- ^ Ларгет Р., Локхарт Б., Ренард П., Ларджерон М. (апрель 2000 г.). «Удобное расширение перегруппировки Вессели-Мозера для синтеза замещенных алкиламинофлавонов в качестве нейрозащитных агентов in vitro». Биоорг. Med. Chem. Латыш. 10 (8): 835–8. Дои:10.1016 / S0960-894X (00) 00110-4. PMID 10782697.
- ^ Харборн, Джеффри Б.; Марби, Хельга; Марби, Т. Дж. (1975). Флавоноиды - Спрингер. Дои:10.1007/978-1-4899-2909-9. ISBN 978-0-12-324602-8.
внешние ссылки
- Флавоны в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)

