Гепаторенальный синдром - Hepatorenal syndrome
| Гепаторенальный синдром | |
|---|---|
| Классификация и внешние ресурсы | |
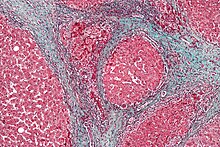 Печень гистология изменен в HRS, в то время как гистология почек в норме. Верхнее изображение - это трихромное пятно (внешний вид проволочной сетки) цирроз печени, наиболее частой причиной HRS. Нижнее изображение - это PAS пятно нормальной гистологии почек. | |
 | |
| МКБ -10 | K76.7 |
| МКБ -9 | 572.4 |
| ЗаболеванияDB | 5810 |
| MedlinePlus | [1] |
| eMedicine | med / 1001 article / 907429 |
| MeSH | D006530 |
Гепаторенальный синдром (часто сокращенно HRS) представляет собой опасное для жизни заболевание, состоящее из быстрое ухудшение функции почек у лиц с цирроз или же молниеносный отказ печени. HRS обычно приводит к летальному исходу, если только пересадка печени выполняется, хотя различные процедуры, такие как диализ, может предотвратить прогрессирование состояния.
HRS может поражать людей с циррозом тяжелой степени. алкогольный гепатит, или печеночная недостаточность, и обычно возникает, когда функция печени быстро ухудшается из-за внезапного инсульта, такого как инфекция, кровотечение в желудочно-кишечном тракте, или чрезмерное использование мочегонное средство лекарства. HRS - это относительно частое осложнение цирроза, которое возникает у 18% людей в течение одного года после постановки диагноза и у 39% в течение пяти лет после постановки диагноза. Ухудшается печень считается, что функция вызывает изменения в кровообращение, которое снабжает кишечник, изменение кровоток и тонус кровеносных сосудов в почки. Почечная недостаточность при HRS является следствием этих изменений кровотока, а не прямым повреждением почек. Диагноз гепаторенального синдрома основан на лабораторных исследованиях лиц, подверженных этому заболеванию. Были определены две формы гепаторенального синдрома: HRS 1 типа влечет за собой быстро прогрессирующее снижение функции почек, в то время как HRS 2 типа связан с асцит (скопление жидкости в брюшной полости), которое не улучшается при стандартном мочегонное средство лекарства.
Риск смерти при гепаторенальном синдроме очень высок; смертность людей с HRS типа 1 составляет более 50% в краткосрочной перспективе, как определено историческими серия случаев. Единственным вариантом длительного лечения этого состояния является трансплантация печени. В ожидании трансплантации люди с HRS часто получают другие методы лечения, которые улучшают нарушения тонуса кровеносных сосудов, включая поддерживающую терапию с помощью лекарств или введение трансъюгулярный внутрипеченочный портосистемный шунт (TIPS), который представляет собой небольшой шунт, устанавливаемый для снижения артериального давления в воротная вена. Некоторым пациентам может потребоваться гемодиализ для поддержки функции почек или более новый метод, называемый диализ печени который использует схему диализа с альбумин -связанные мембраны для связывания и удаления токсинов, обычно выводимых печенью, обеспечивая средство экстракорпоральная поддержка печени пока не будет проведена трансплантация.
Классификация

Гепаторенальный синдром - частный и распространенный тип почечная недостаточность что поражает людей с печенью цирроз или, реже, с фульминантная печеночная недостаточность.[1] Синдром включает сужение кровеносных сосудов почки и расширение кровеносных сосудов внутреннего кровообращения, снабжающего кишечник.[2] Классификация гепаторенального синдрома выделяет две категории почечная недостаточность, названный Тип 1 и тип 2 HRS, которые возникают у людей с цирроз или же фульминантная печеночная недостаточность. В обеих категориях ухудшение функции почек количественно оценивается либо по увеличению креатинин уровень в крови, или снижение клиренса креатинина с мочой.[3]
Гепаторенальный синдром 1 типа
HRS 1 типа характеризуется быстро прогрессирующей почечной недостаточностью с удвоением сыворотки крови. креатинин до уровня выше 221 мкмоль / Л (2,5 мг /дл ) или уменьшение вдвое клиренс креатинина до менее 20 мл / мин в течение менее двух недель. Прогноз для людей с HRS 1 типа особенно мрачный, с смертность превышает 50% через месяц.[4] Пациенты с HRS 1 типа обычно болеют, могут иметь низкое кровяное давление, и может потребоваться терапия препаратами для увеличения силы сокращения сердечной мышцы (инотропы ) или другие препараты для поддержания артериального давления (вазопрессоры ).[5] В отличие от II типа, при гепаторенальном синдроме I почечная недостаточность улучшается при лечении и стабилизируется. Вазоконстрикторы и расширители объема являются основой лечения.[6]
Гепаторенальный синдром 2 типа
Напротив, HRS 2 типа протекает медленнее по началу и прогрессированию и не связан с побуждающим событием. Определяется увеличением сыворотки крови. креатинин уровень> 133 мкмоль / л (1,5 мг / дл) или клиренс креатинина менее 40 мл / мин, а уровень натрия в моче <10 мкмоль / л.[7] Он также имеет плохую перспективу, со средней выживаемостью около шести месяцев, если пострадавший не подвергнется трансплантации печени. Считается, что HRS 2 типа является частью спектра заболеваний, связанных с: повышенное давление в кровотоке воротной вены, который начинается с выработки жидкости в брюшной полости (асцит ). Спектр продолжается устойчивый к диуретикам асцит, когда почки не могут выводить достаточно натрия, чтобы очистить жидкость даже при использовании мочегонных препаратов. Большинство людей с HRS 2 типа имеют устойчивый к диуретикам асцит до того, как у них разовьется ухудшение функции почек.[8]
Признаки и симптомы
Оба типа гепаторенального синдрома имеют три основных компонента: нарушение функции печени, нарушения кровообращения и почечную недостаточность. Поскольку эти явления не обязательно могут вызывать симптомы до поздней стадии своего развития, у людей с гепаторенальным синдромом это состояние обычно диагностируется на основании измененных лабораторных тестов. Большинство людей, у которых развивается HRS, страдают циррозом печени и могут иметь его признаки и симптомы, в том числе: желтуха, изменения психического состояния, свидетельства пониженного питания и наличие асцит.[2] В частности, производство асцита, устойчивого к использованию мочегонное средство лекарства характерны для HRS 2 типа. Олигурия, то есть уменьшение объема мочи, может возникнуть как следствие почечной недостаточности; однако некоторые люди с HRS продолжают выделять нормальное количество мочи.[3] Поскольку эти признаки и симптомы не обязательно могут возникать при HRS, они не включены в основные и второстепенные критерии для постановки диагноза этого состояния; вместо этого диагноз HRS ставится у человека, подверженного риску заболевания, на основании результатов лабораторных тестов и исключения других причин.[3]
Причины
Гепаторенальный синдром обычно поражает людей с цирроз и повышенное давление в воротная вена система (называемая портальная гипертензия ). Хотя HRS может развиваться в любом типе цирроз, это чаще всего встречается у людей с алкогольный цирроз, особенно если есть сопутствующие алкогольный гепатит идентифицируемый при биопсии печени.[9] HRS также может возникать у людей без цирроза, но с острым началом печеночной недостаточности, называемой фульминантная печеночная недостаточность.[3][9]
Определенные факторы, вызывающие HRS, были обнаружены у уязвимых лиц с циррозом или фульминантной печеночной недостаточностью. К ним относятся бактериальные инфекции, острые алкогольный гепатит, или же кровотечение в верхних отделах желудочно-кишечного тракта. Спонтанный бактериальный перитонит, что является инфекцией асцит жидкость, является наиболее частым преципитентом HRS у пациентов с циррозом. HRS иногда может быть вызван лечением осложнений заболевания печени: ятрогенный осадители HRS включают агрессивное использование мочегонное средство лекарства или удаление больших объемов асцитическая жидкость к парацентез из брюшной полости без компенсации потерь жидкости путем внутривенного замещения.[9]
Диагностика
У людей с циррозом или фульминантной печеночной недостаточностью может быть много причин почечной недостаточности. Следовательно, сложно отличить гепаторенальный синдром от других состояний, вызывающих почечную недостаточность на фоне прогрессирующего заболевания печени. В результате были разработаны дополнительные основные и второстепенные критерии, чтобы помочь в диагноз гепаторенального синдрома.[3]
В основной критерии включают заболевание печени с портальная гипертензия; почечная недостаточность; отсутствие шок, инфекционное заболевание, недавнее лечение лекарствами, влияющими на функцию почек (нефротоксины ) и потери жидкости; отсутствие устойчивого улучшения функции почек, несмотря на лечение 1,5 л внутривенный физиологический раствор; отсутствие протеинурия (белок в моча ); а также отсутствие заболевания почек или обструкции оттока почек, как показано на УЗИ.[3]
В незначительный критерии следующие: низкий объем мочи (менее 500 мл (18 имп. жидких унций; 17 жидких унций США) в день), низкая натрий концентрация в моче, а осмоляльность мочи это больше, чем в кровь, отсутствие красные кровяные тельца в моче и концентрация натрия в сыворотке менее 130 ммоль / л.[3]
Многие другие заболевания почек связаны с заболеванием печени и должны быть исключены перед постановкой диагноза гепаторенального синдрома. Лица с преренальная почечная недостаточность не имеют повреждений почек, но, как и у людей с HRS, имеют почечную дисфункцию из-за снижения притока крови к почкам. Также, как и HRS, преренальная почечная недостаточность вызывает образование мочи с очень низкой концентрацией натрия. Однако, в отличие от HRS, преренальная почечная недостаточность обычно поддается лечению внутривенными жидкостями, что приводит к снижению сывороточного уровня. креатинин и повышенное выведение натрия.[3] Острый тубулярный некроз (ATN) включает повреждение канальцев почек и может быть осложнением у людей с циррозом печени из-за воздействия токсичных лекарств или развития снижения артериального давления. Из-за повреждения канальцев почки, пораженные АТН, обычно не могут максимально абсорбировать натрий из мочи. В результате ATN можно отличить от HRS на основе лабораторных исследований, поскольку у людей с ATN показатели натрия в моче будут намного выше, чем при HRS; однако это может быть не всегда так при циррозе печени.[5] Лица с ATN также могут иметь доказательства гиалиновые слепки или же мутно-коричневые отливки в моче при микроскопии, в то время как моча людей с HRS обычно лишена клеточного материала, поскольку почки не были повреждены напрямую.[3] Некоторые вирусные инфекции печени, в том числе гепатит Б и гепатит С также может привести к воспалению клубочки почки.[10][11] Другие причины почечной недостаточности у людей с заболеваниями печени включают токсичность лекарств (особенно антибиотика). гентамицин ) или же контрастная нефропатия, вызванные внутривенным введением контраст агенты, используемые для тестов медицинской визуализации.[3]
Патофизиология


В почечная недостаточность при гепаторенальном синдроме возникает из-за аномалий в кровеносный сосуд тонус в почках.[2] Преобладающая теория (названная недозаполнение теория) заключается в том, что кровеносные сосуды в системе кровообращения почек сужены из-за расширения кровеносных сосудов в внутреннее кровообращение (который поставляет кишечник ), который опосредуется факторами, вызываемыми заболеванием печени.[4][12] Оксид азота,[13] простагландины,[2][14] и другие вазоактивные вещества[2] были выдвинуты гипотезы как мощные медиаторы внутренней вазодилатации при циррозе печени.[2] Следствием этого явления является уменьшение «эффективного» объема крови, воспринимаемого юкстагломерулярный аппарат, что приводит к секреции ренин и активация ренин-ангиотензиновая система, что приводит к сужению сосудов системно и в частности почек.[2] Однако эффект от этого недостаточен, чтобы противодействовать медиаторам расширения сосудов в внутреннем круге кровообращения, что приводит к стойкому «недозаполнению» почечного кровообращения и ухудшению вазоконстрикции почек, что приводит к почечной недостаточности.[12]
Исследования для количественной оценки этой теории показали, что общее снижение системное сосудистое сопротивление при гепаторенальном синдроме, но размеренный бедренный и почечные фракции сердечный выброс соответственно увеличиваются и уменьшаются, что позволяет предположить, что внутренняя расширение сосудов причастен к почечной недостаточности.[15] Было выдвинуто предположение, что многие вазоактивные химические вещества участвуют в опосредовании системных гемодинамических изменений, включая предсердный натрийуретический фактор,[16] простациклин, тромбоксан A2,[17] и эндотоксин.[4] В дополнение к этому, было замечено, что прием лекарств, противодействующих расширению внутренних сосудов (например, орнипрессин,[16] терлипрессин,[18] и октреотид )[19] приводит к улучшению скорость клубочковой фильтрации (который является количественным показателем функции почек) у пациентов с гепаторенальным синдромом, что является дополнительным доказательством того, что внутренняя вазодилатация является ключевым признаком его патогенеза.
Теория недостаточного наполнения включает активацию системы ренин-ангиотензин-альдостерон, что приводит к увеличению абсорбции натрия из почечных канальцев (называемой почечная авидность натрия) при посредничестве альдостерон, который действует на минералокортикоидные рецепторы в дистальный извитый каналец.[8][12] Считается, что это ключевой шаг в патогенезе асцит при циррозе печени. Была выдвинута гипотеза, что прогрессирование от асцита к гепаторенальному синдрому представляет собой спектр, в котором внутренняя вазодилатация определяет как устойчивость к мочегонное средство прием лекарств при асците (который обычно наблюдается при HRS 2 типа) и начале почечной вазоконстрикции (как описано выше), что приводит к гепаторенальному синдрому.[8]
Профилактика

Риск смерти при гепаторенальном синдроме очень высок; следовательно, большое внимание уделяется выявлению пациентов, которые подвержены риску HRS, и предотвращению триггеров для начала HRS. В качестве инфекционное заболевание (конкретно спонтанный бактериальный перитонит ) и желудочно-кишечное кровотечение являются осложнениями у людей с циррозом и являются обычными триггерами HRS, поэтому при раннем выявлении и лечении цирроза с этими осложнениями уделяется особое внимание для предотвращения HRS.[5] Некоторые триггеры HRS вызваны лечением асцит и ее можно предотвратить. Агрессивное использование мочегонное средство следует избегать приема лекарств. Кроме того, многие лекарства, которые используются для лечения циррозных осложнений (например, некоторые антибиотики) или других состояний, могут вызывать значительное нарушение функции почек при циррозе, что приводит к HRS.[4][5] Также большой объем парацентез - это удаление асцит жидкость из брюшной полости с помощью иглы или катетер для уменьшения дискомфорта - может вызвать изменения в гемодинамике, достаточные для ускорения HRS, и этого следует избегать у лиц из группы риска. Сопутствующий настой альбумин может предотвратить дисфункцию кровообращения, которая возникает после парацентеза большого объема, и может предотвратить HRS.[20] И наоборот, у людей с очень напряженным асцитом была выдвинута гипотеза, что удаление асцитической жидкости может улучшить функцию почек, если она снижает давление на почечные вены.[21]
Лица с асцитом, заразившиеся спонтанно (так называемые спонтанный бактериальный перитонит или SBP) имеют особенно высокий риск развития HRS.[2] У лиц с САД один рандомизированное контролируемое исследование обнаружили, что введение альбумина внутривенно в день госпитализации и на третий день пребывания в больнице снижает как уровень почечной недостаточности, так и смертность.[22]
Уход
Трансплантация
Окончательное лечение гепаторенального синдрома: трансплантация печени, и все другие методы лечения лучше всего можно описать как мосты к трансплантации.[1][23] Хотя трансплантация печени на сегодняшний день является наилучшим доступным вариантом лечения HRS, было показано, что смертность людей с HRS достигает 25% в течение первого месяца после трансплантации.[24] Лица с HRS и доказательствами более выраженной печеночной дисфункции (количественно выражено как MELD баллов выше 36) оказались подвержены наибольшему риску ранней смерти после трансплантации печени.[24] Дальнейшее ухудшение функции почек даже после трансплантации печени у людей с HRS было продемонстрировано в нескольких исследованиях; однако это временно и, как считается, связано с использованием лекарства, токсичные для почек и, в частности, введение иммунодепрессанты Такие как такролимус и циклоспорин которые, как известно, ухудшают функцию почек.[2] Однако в долгосрочной перспективе у людей с HRS, которые являются реципиентами трансплантации печени, почти всегда восстанавливается функция почек, и исследования показывают, что их выживаемость через три года аналогична показателям тех, кто получил трансплантацию печени по причинам, отличным от HRS.[1][2]
В ожидании трансплантации печени (которая может быть связана со значительной задержкой госпитализации) было обнаружено, что несколько других стратегий оказались полезными для сохранения функции почек. К ним относятся использование внутривенных альбумин настой, лекарства (для которых лучше всего подходят аналоги вазопрессин, что вызывает сужение внутренних сосудов), радиологические шунты уменьшаются давление в воротной вене, диализ, и специализированная мембранная диализная система с альбумином, называемая система рециркуляции молекулярных адсорбентов (МАРС) или диализ печени.[2]
Лечебная терапия
Многие крупные исследования, показывающие улучшение функции почек у пациентов с гепаторенальным синдромом, включали увеличение объема плазма с альбумин внутривенно.[2][25][26] Количество альбумина, вводимого внутривенно, варьируется: одна из указанных схем составляет 1 грамм альбумина на килограмм веса тела внутривенно в первый день, а затем от 20 до 40 граммов ежедневно.[27] Примечательно, что исследования показали, что лечение одним альбумином уступает лечению другими лекарствами в сочетании с альбумином; Большинство исследований, посвященных оценке предтрансплантационных методов лечения HRS, включают использование альбумина в сочетании с другим медицинским или процедурным лечением.[2][28]
Мидодрин является альфа-агонист и октреотид является аналогом соматостатин, гормон, участвующий в регуляции тонус кровеносных сосудов желудочно-кишечного тракта. Лекарства являются соответственно системными вазоконстрикторами и ингибиторами внутренней вазодилатации, и не было обнаружено, что они полезны при индивидуальном применении при лечении гепаторенального синдрома.[1][2][29] Однако одно исследование с участием 13 пациентов с гепаторенальным синдромом показало значительное улучшение функции почек при одновременном применении этих двух препаратов (при пероральном приеме мидодрина и назначении октреотида подкожно и оба дозированы в соответствии с артериальным давлением), при этом трое пациентов дожили до выписки.[30] Другое нерандомизированное обсервационное исследование лиц с HRS, получавших подкожный октреотид и пероральный мидодрин, показало, что выживаемость увеличилась через 30 дней.[1][31]
В аналог вазопрессина орнипрессин в ряде исследований было обнаружено, что он полезен для улучшения функции почек у пациентов с гепаторенальным синдромом,[1][25][32] но его использование было ограничено, так как оно может вызвать серьезные ишемия к основным органам.[1][25] Терлипрессин представляет собой аналог вазопрессина, который, как было обнаружено в одном большом исследовании, полезен для улучшения функции почек у пациентов с гепаторенальным синдромом с меньшей частотой ишемии, но недоступен в США.[1][26] В сентябре 2020 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США опубликовало письмо с полным ответом, в котором говорилось, что на основе имеющихся данных агентство не может одобрить NDA для терлипрессина в его нынешней форме и требует дополнительной информации для поддержки положительного профиля риска и пользы для терлипрессина для пациенты с HRS-1. Основная критика всех этих методов лечения заключалась в неоднородности исследуемых популяций и использовании функции почек вместо смертности в качестве критерия результата.[33]
Другие агенты, которые были исследованы для использования при лечении HRS, включают: пентоксифиллин,[34] ацетилцистеин,[35] и мизопростол.[1][36] Доказательства для всех этих методов лечения основаны либо на серия случаев, или, в случае пентоксифиллина, экстраполированное от подгруппы пациентов, получавших лечение от алкогольный гепатит.[1]
Процедурные процедуры
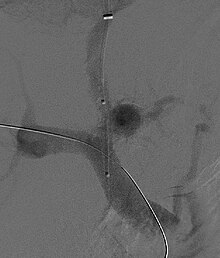
А трансъюгулярный внутрипеченочный портосистемный шунт (TIPS) включает декомпрессию высокого давления в портал кровообращение, поместив небольшой стент между портал и печеночная вена. Это делается с помощью катетеров под радиологическим контролем, которые вводятся в печеночную вену либо через внутренняя яремная вена или бедренная вена. Теоретически считается, что снижение портального давления обращает вспять гемодинамические явления, которые в конечном итоге приводят к развитию гепаторенального синдрома. Было показано, что TIPS улучшает функцию почек у пациентов с гепаторенальным синдромом.[8][37][38] Осложнения TIPS для лечения HRS включают ухудшение печеночная энцефалопатия (поскольку процедура включает принудительное создание порто-системного шунта, эффективно обходя способность печени выводить токсины), неспособность достичь адекватного снижения портального давления и кровотечение.[8][37]
Диализ печени включает экстракорпоральный диализ для удаления токсинов из кровотока, как правило, путем добавления второго диализного контура, содержащего мембрану, связанную с альбумином. В система рециркуляции молекулярных адсорбентов (MARS) показала некоторую полезность в качестве моста к трансплантации у пациентов с гепаторенальным синдромом, но этот метод все еще находится в стадии разработки.[8][39]
Заместительная почечная терапия может потребоваться для перехода людей с гепаторенальным синдромом к трансплантации печени, хотя состояние пациента может диктовать используемый метод.[40] Использование диализ тем не менее, не приводит к восстановлению или сохранению функции почек у пациентов с HRS, и в основном используется только для предотвращения осложнений, связанных с почечной недостаточностью, до трансплантации. У пациентов, перенесших гемодиализ, может даже быть повышенный риск смерти из-за низкое кровяное давление у пациентов с HRS, хотя соответствующие исследования еще не проводились. В результате роль заместительной почечной терапии у пациентов с HRS остается неясной.[2]
Эпидемиология
Поскольку у большинства людей с гепаторенальным синдромом цирроз, большая часть эпидемиологических данных по HRS поступает от пациентов с циррозом печени. Состояние довольно распространенное: примерно 10% пациентов, госпитализированных с асцит есть HRS.[9] Ретроспективная серия случаев пациентов с циррозом, получавших терлипрессин, показала, что 20,0% острой почечной недостаточности при циррозе печени было связано с HRS 1 типа, а 6,6% - с HRS 2 типа.[18] Подсчитано, что 18% людей с цирроз и асцит HRS разовьется в течение одного года с момента постановки диагноза цирроза, и у 39% этих людей будет развиваться HRS в течение пяти лет после постановки диагноза.[9] Были идентифицированы три независимых фактора риска развития HRS при циррозе: размер печени, активность ренина в плазме и концентрация натрия в сыворотке.[9]
Прогноз для этих пациентов мрачный, поскольку нелеченные пациенты имеют чрезвычайно короткую выживаемость.[4][9][23] Степень тяжести заболевания печени (о чем свидетельствует MELD оценка), как было показано, является определяющим фактором результата.[24][41] У некоторых пациентов без цирроза печени развивается HRS с частотой около 20%, наблюдаемой в одном исследовании больных с алкогольный гепатит.[34]
История
Первые сообщения о почечной недостаточности у людей с хроническими заболеваниями печени относятся к концу 19 века Фрерихсом и Флинтом.[9] Однако сначала гепаторенальный синдром был определен как острая почечная недостаточность, возникшая в условиях билиарная хирургия.[1][42] Синдром вскоре снова стал ассоциироваться с запущенным заболеванием печени.[23] и в 1950-х годах был клинически определен Шерлок, Hecker, Papper и Vessin, как связанные с системными гемодинамическими нарушениями и высокой смертностью.[9][43] Хекер и Шерлок специально определили, что у людей с HRS был низкий диурез, очень низкий натрий в моче, а в моче нет белка.[1] Мюррей Эпштейн был первым, кто охарактеризовал расширение внутренних сосудов и сужение сосудов почек как ключевые изменения гемодинамики у пациентов с этим синдромом.[44] Функциональная природа почечной недостаточности при HRS была подтверждена исследованиями, демонстрирующими, что почки, трансплантированные от пациентов с гепаторенальным синдромом, вернулись к работе в новом хозяине,[45] что привело к гипотезе о том, что гепаторенальный синдром является системным заболеванием, а не заболеванием почек. Первая систематическая попытка определения гепаторенального синдрома была предпринята в 1994 году Международным асцитным клубом, группой исследователей. специалисты по печени. Более поздняя история HRS включала в себя выяснение различных вазоактивных медиаторов, которые вызывают аномалии чревного и почечного кровотока при этом состоянии.[9]
Рекомендации
- ^ а б c d е ж грамм час я j k л Нг СК, Чан М.Х., Тай М.Х., Лам С.В. (февраль 2007 г.). «Гепаторенальный синдром». Clin Biochem Rev. 28 (1): 11–7. ЧВК 1904420. PMID 17603637.
- ^ а б c d е ж грамм час я j k л м п о Ginès P, Arroyo V (1999). «Гепаторенальный синдром». Варенье. Soc. Нефрол. 10 (8): 1833–9. PMID 10446954. Получено 17 июля 2009.
- ^ а б c d е ж грамм час я j Арройо В., Жинес П., Гербес А.Л. и др. (1996). «Определение и диагностические критерии рефрактерного асцита и гепаторенального синдрома при циррозе печени. Международный асцитный клуб». Гепатология. 23 (1): 164–76. Дои:10.1002 / hep.510230122. PMID 8550036.
- ^ а б c d е Арройо В., Гевара М., Жинес П. (2002). «Гепаторенальный синдром при циррозе печени: патогенез и лечение». Гастроэнтерология. 122 (6): 1658–76. Дои:10.1053 / gast.2002.33575. PMID 12016430.
- ^ а б c d Мукерджи, С. Гепаторенальный синдром. emedicine.com. Проверено 2 августа 2009 г.
- ^ Lenz K; и другие. (Март 2015 г.). «Лечение и лечение асцита и гепаторенального синдрома: обновленная информация». Терапевтические достижения в гастроэнтерологии. 8 (2): 83–100. Дои:10,1177 / 1756283x14564673.
- ^ Ginés P, Arroyo V, Quintero E, et al. (1987). «Сравнение парацентеза и диуретиков при лечении цирроза печени с напряженным асцитом. Результаты рандомизированного исследования». Гастроэнтерология. 93 (2): 234–41. Дои:10.1016/0016-5085(87)91007-9. PMID 3297907.
- ^ а б c d е ж Блендис Л., Вонг Ф. (2003). «Естественное течение и лечение гепаторенальных заболеваний: от преасцита до гепаторенального синдрома» (PDF). Clin Med. 3 (2): 154–9. Дои:10.7861 / Clinmedicine.3-2-154. ЧВК 4952737. PMID 12737373.
- ^ а б c d е ж грамм час я j Ginès A, Escorsell A, Ginès P и др. (1993). «Заболеваемость, прогностические факторы и прогноз гепаторенального синдрома при циррозе печени с асцитом». Гастроэнтерология. 105 (1): 229–36. Дои:10.1016/0016-5085(93)90031-7. PMID 8514039.
- ^ Хан Ш. (2004). «Внепеченочные проявления хронического гепатита В». Clin Liver Dis. 8 (2): 403–18. Дои:10.1016 / j.cld.2004.02.003. PMID 15481347.
- ^ Филипнери М., Бастани Б. (февраль 2001 г.). «Заболевания почек у больных хроническим гепатитом С». Curr Gastroenterol Rep. 3 (1): 79–83. Дои:10.1007 / s11894-001-0045-0. PMID 11177699.
- ^ а б c Шриер Р. У., Арройо В., Бернарди М., Эпштейн М., Хенриксен Дж. Х., Родес Дж. (1988). «Гипотеза периферической артериальной вазодилатации: предложение для инициации почечной задержки натрия и воды при циррозе». Гепатология. 8 (5): 1151–7. Дои:10.1002 / hep.1840080532. PMID 2971015.
- ^ Мартин П. Я., Жинес П., Шриер Р. В. (август 1998 г.). «Оксид азота как медиатор гемодинамических нарушений и задержки натрия и воды при циррозе печени». N. Engl. J. Med. 339 (8): 533–41. Дои:10.1056 / NEJM199808203390807. PMID 9709047.
- ^ Эпштейн М (апрель 1994). «Гепаторенальный синдром: новые перспективы патофизиологии и терапии». Варенье. Soc. Нефрол. 4 (10): 1735–53. PMID 8068872.
- ^ Фернандес-Сеара Дж., Прието Дж., Кирога Дж. И др. (1989). «Системная и региональная гемодинамика у пациентов с циррозом печени и асцитом с функциональной почечной недостаточностью и без нее». Гастроэнтерология. 97 (5): 1304–12. Дои:10.1016/0016-5085(89)91704-6. PMID 2676683.
- ^ а б Ленц К., Хёртнагл Х., Драмл В. и др. (1991). «Орнипрессин в лечении функциональной почечной недостаточности при декомпенсированном циррозе печени. Влияние на почечную гемодинамику и предсердный натрийуретический фактор». Гастроэнтерология. 101 (4): 1060–7. Дои:10.1016/0016-5085(91)90734-3. PMID 1832407.
- ^ Мур К., Уорд П.С., Тейлор Г.В., Уильямс Р. (1991). «Системная и почечная продукция тромбоксана А2 и простациклина при декомпенсированной болезни печени и гепаторенальном синдроме». Гастроэнтерология. 100 (4): 1069–77. Дои:10.1016 / 0016-5085 (91) 90284-р. PMID 2001805.
- ^ а б Моро Р., Дюран Ф, Пойнард Т., Дюамель С., Червони Дж. П., Ичай П., Абергель А., Халими С., Пауэлс М., Броновицкий Дж. П., Джостра Е., Флеро С., Гурно Д., Ноуэль О, Ренар П., Ривоал М., Блан П. , Coumaros D, Ducloux S, Levy S, Pariente A, Perarnau JM, Roche J, Scribe-Outtas M, Valla D, Bernard B, Samuel D, Butel J, Hadengue A, Platek A, Lebrec D, Cadranel JF (апрель 2002 г. ). «Терлипрессин у пациентов с циррозом и гепаторенальным синдромом 1 типа: ретроспективное многоцентровое исследование». Гастроэнтерология. 122 (4): 923–30. Дои:10.1053 / gast.2002.32364. PMID 11910344.
- ^ Каффи Ф., Бордери С., Шагно С. и др. (Январь 1999 г.). «Октреотид в лечении гепаторенального синдрома у пациентов с циррозом печени». J. Hepatol. 30 (1): 174. Дои:10.1016 / S0168-8278 (99) 80025-7. PMID 9927168.
- ^ Веламати П.Г., Херлонг Х.Ф. (2006). «Лечение рефрактерного асцита». Варианты лечения Curr Гастроэнтерол. 9 (6): 530–7. Дои:10.1007 / s11938-006-0009-4. PMID 17081486.
- ^ Шерлок С., Дули Дж. (2002). «Глава 9». Заболевания печени и желчевыводящей системы. выпуск 11. Wiley-Blackwell. ISBN 978-0-632-05582-1.
- ^ Сорт P, Navasa M, Arroyo V и др. (1999). «Влияние внутривенного альбумина на почечную недостаточность и смертность у пациентов с циррозом печени и спонтанным бактериальным перитонитом». N. Engl. J. Med. 341 (6): 403–9. Дои:10.1056 / NEJM199908053410603. PMID 10432325.
- ^ а б c Вонг Ф., Блендис Л. (2001). «Новая проблема гепаторенального синдрома: профилактика и лечение». Гепатология. 34 (6): 1242–51. Дои:10.1053 / jhep.2001.29200. PMID 11732014.
- ^ а б c Xu X, Ling Q, Zhang M и др. (Май 2009 г.). «Исход пациентов с гепаторенальным синдромом 1 типа после трансплантации печени: опыт Ханчжоу». Трансплантация. 87 (10): 1514–9. Дои:10.1097 / TP.0b013e3181a4430b. PMID 19461488.
- ^ а б c Гевара М., Жинес П., Фернандес-Эспаррах Г. и др. (1998). «Обратимость гепаторенального синдрома при длительном применении орнипрессина и увеличении объема плазмы». Гепатология. 27 (1): 35–41. Дои:10.1002 / hep.510270107. PMID 9425914.
- ^ а б Ортега Р., Жинес П., Уриз Дж. И др. (2002). «Терапия терлипрессином с альбумином и без него для пациентов с гепаторенальным синдромом: результаты проспективного нерандомизированного исследования». Гепатология. 36 (4, п. 1): 941–8. Дои:10.1053 / jhep.2002.35819. PMID 12297842.
- ^ Ginès P, Cárdenas A, Arroyo V, Rodés J (2004). «Ведение цирроза и асцита». N. Engl. J. Med. 350 (16): 1646–54. Дои:10.1056 / NEJMra035021. PMID 15084697.
- ^ Мартин-Ллахи М., Пепин М.Н., Гевара М. и др. (Май 2008 г.). «Терлипрессин и альбумин против альбумина у пациентов с циррозом и гепаторенальным синдромом: рандомизированное исследование». Гастроэнтерология. 134 (5): 1352–9. Дои:10.1053 / j.gastro.2008.02.024. PMID 18471512.
- ^ Помье-Лайрарг Г., Пакин С.К., Хассун З., Лафортюн М., Тран А (2003). «Октреотид при гепаторенальном синдроме: рандомизированное двойное слепое плацебо-контролируемое перекрестное исследование». Гепатология. 38 (1): 238–43. Дои:10.1053 / jhep.2003.50276. PMID 12830007.
- ^ Анджели П., Вольпин Р., Герунда Г. и др. (1999). «Лечение гепаторенального синдрома 1 типа с применением мидодрина и октреотида». Гепатология. 29 (6): 1690–7. Дои:10.1002 / hep.510290629. PMID 10347109.
- ^ Esrailian E, Pantangco ER, Kyulo NL, Hu KQ, Runyon BA (2007). «Терапия октреотидом / мидодрином значительно улучшает функцию почек и 30-дневную выживаемость у пациентов с гепаторенальным синдромом 1 типа». Копать землю. Dis. Наука. 52 (3): 742–8. Дои:10.1007 / s10620-006-9312-0. PMID 17235705.
- ^ Гюльберг В., Билзер М., Гербес А.Л. (1999). «Длительная терапия и повторное лечение гепаторенального синдрома 1 типа орнипрессином и дофамином». Гепатология. 30 (4): 870–5. Дои:10.1002 / hep.510300430. PMID 10498636.
- ^ Тандон П., Бейн В.Г., Цуюки Р.Т., Кларенбах С. (май 2007 г.). «Систематический обзор: почечные и другие клинически значимые результаты в исследованиях гепаторенального синдрома». Алимент. Pharmacol. Ther. 25 (9): 1017–28. Дои:10.1111 / j.1365-2036.2007.03303.x. PMID 17439502.
- ^ а б Акривиадис Э., Ботла Р., Бриггс В., Хан С., Рейнольдс Т., Шакил О. (2000). «Пентоксифиллин улучшает краткосрочную выживаемость при тяжелом остром алкогольном гепатите: двойное слепое плацебо-контролируемое исследование». Гастроэнтерология. 119 (6): 1637–48. Дои:10.1053 / gast.2000.20189. PMID 11113085.
- ^ Холт С., Гудье Д., Марли Р. и др. (1999). «Улучшение функции почек при гепаторенальном синдроме с помощью N-ацетилцистеина». Ланцет. 353 (9149): 294–5. Дои:10.1016 / S0140-6736 (05) 74933-3. PMID 9929029.
- ^ Клевелл Дж. Д., Уокер-Ренард П. (1994). «Простагландины для лечения гепаторенального синдрома». Энн Фармакотер. 28 (1): 54–5. Дои:10.1177/106002809402800112. PMID 8123962.
- ^ а б Вонг Ф., Пантея Л., Снайдерман К. (2004). «Мидодрин, октреотид, альбумин и TIPS у отдельных пациентов с циррозом печени и гепаторенальным синдромом 1 типа». Гепатология. 40 (1): 55–64. Дои:10.1002 / hep.20262. PMID 15239086.
- ^ Гевара М, Родес Дж (2005). «Гепаторенальный синдром». Int. J. Biochem. Cell Biol. 37 (1): 22–6. Дои:10.1016 / j.biocel.2004.06.007. PMID 15381144.
- ^ Мицнер С.Р., Штанге Дж., Кламмт С. и др. (2000). «Улучшение гепаторенального синдрома с помощью экстракорпорального альбуминового диализа MARS: результаты проспективного рандомизированного контролируемого клинического исследования». Трансплантация печени. 6 (3): 277–86. Дои:10.1053 / lv.2000.6355. PMID 10827226.
- ^ Витцке О., Бауманн М., Патчан Д. и др. (2004). «Какие пациенты получают пользу от терапии гемодиализом при гепаторенальном синдроме?». J. Gastroenterol. Гепатол. 19 (12): 1369–73. Дои:10.1111 / j.1440-1746.2004.03471.x. PMID 15610310.
- ^ Алессандрия С., Оздоган О, Гевара М. и др. (2005). «Оценка MELD и клинический тип предсказывают прогноз при гепаторенальном синдроме: актуальность для трансплантации печени». Гепатология. 41 (6): 1282–9. Дои:10.1002 / hep.20687. PMID 15834937.
- ^ Helwig FC, Schutz CB (1932). «Синдром печени почек. Клинико-патологические и экспериментальные исследования». Хирургический гинекологический акушер. 55: 570–80.
- ^ Хекер Р., Шерлок С. (декабрь 1956 г.). «Электролитные и кровеносные изменения при терминальной печеночной недостаточности». Ланцет. 271 (6953): 1121–5. Дои:10.1016 / с0140-6736 (56) 90149-0. PMID 13377688.
- ^ Wadei HM, Mai ML, Ahsan N, Gonwa TA (сентябрь 2006 г.). «Гепаторенальный синдром: патофизиология и лечение». Clin J Am Soc Nephrol. 1 (5): 1066–79. Дои:10.2215 / CJN.01340406. PMID 17699328.
- ^ Коппель MH, Кобурн JW, Мимс MM, Голдштейн H, Бойл JD, Rubini ME (1969). «Трансплантация трупных почек от пациентов с гепаторенальным синдромом. Доказательства функциональной природы почечной недостаточности при запущенном заболевании печени». N. Engl. J. Med. 280 (25): 1367–71. Дои:10.1056 / NEJM196906192802501. PMID 4890476.
