Этонитазен - Etonitazene
 | |
 | |
| Клинические данные | |
|---|---|
| Код УВД |
|
| Легальное положение | |
| Легальное положение | |
| Идентификаторы | |
| |
| Количество CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| ЧЭМБЛ | |
| Панель управления CompTox (EPA) | |
| ECHA InfoCard | 100.011.827 |
| Химические и физические данные | |
| Формула | C22ЧАС28N4О3 |
| Молярная масса | 396.491 г · моль−1 |
| 3D модель (JSmol ) | |
| |
| |
| | |
Этонитазен является обезболивающее препарат, впервые зарегистрированный в 1957 г.,[1] который, как было показано, имеет примерно от тысячи до тысячи пятисот раз больше потенция из морфий в моделях на животных, но только в шестьдесят раз эффективнее у людей.[2][нужен лучший источник ]
Потому что для него характерен сильный потенциал зависимости и склонность производить глубокие угнетение дыхания, он не используется в организме человека. Однако это полезно в моделях на животных для зависимость исследования, особенно те, которые требуют от животных пить или проглатывать агент, потому что он не такой горький, как опиатные соли, такие как сульфат морфина.[нужна цитата ]
Незаконное производство
Незаконное производство и продажа этонитазена ограничены. Выявлено на Москва нелегальный рынок наркотиков в 1998 году его в основном курили в сигаретах со шнурками.[3] Химик в Мортон Тиокол[4] произвел соединение и поместил его в назальный ингалятор. Препарат был произведен в России в 1996 году и продавался как «Китайский гном». Это лекарство привело к неподтвержденному количеству смертей из-за его неопределенной силы действия.[5] Похоже, крутой кривая доза-ответ и непредсказуемая фармакокинетика, особенно при инъекции, аналогично некоторым другим сильнодействующим опиоидам, таким как декстроморамид, что может сделать этонитазен особенно опасным по сравнению с опиоидами аналогичной силы, такими как фентанил.[6]
Аналоги
Известен ряд аналогов, и единственное другое хорошо известное соединение, вышедшее из оригинальных исследований 1950-х годов, - это клонитазен, который намного слабее этонитазена (примерно в 3 раза больше морфина). Совсем недавно, примерно с конца 2018 года, ряд дизайнер аналоги начали появляться на незаконных рынках по всему миру, причем наиболее известными соединениями являются метонитазен, изотонитазен и этазен, хотя другие продолжали появляться.[7][8]
Из этих аналогов только этонитазен и клонитазен прямо перечислены в конвенциях ООН и поэтому контролируются во всем мире. Остальное будет незаконным только в таких странах, как США, Австралия и Новая Зеландия, в которых действуют законы, эквивалентные Федеральный закон об аналогах. В Соединенных Штатах это наркотик Списка I. контролируемое вещество с DEA ACSCN 9624 и нулевой годовой производственной квотой с 2013 года.
Синтез
Этонитазен и родственные ему опиоид агонист бензимидазолы были обнаружены в конце 1950-х гг.,[9][10][11][12][13][14] командой швейцарских исследователей, работающих в фармацевтической фирме CIBA (сейчас Новартис ). Одним из первых соединений, исследованных швейцарской командой, был 1- (β-диэтиламиноэтил) -2-бензилбензимидазол, который, как было обнаружено, обладает 10% анальгетической активности морфина при испытаниях в биопробах на грызунах. Это открытие побудило группу начать всестороннее систематическое исследование 2-бензилбензимидазолов и установить взаимосвязь структура-деятельность этого нового семейства анальгетиков. Для получения этих соединений были разработаны два общих синтетических метода.
Первый метод заключался в конденсации о-фенилендиамин с фенилацетонитрил с образованием 2-бензилбензимидазола. Затем бензимидазол алкилируют желаемым 1-хлор-2-диалкиламиноэтаном с образованием конечного продукта. Эта конкретная процедура была наиболее полезной для получения бензимидазолов, у которых отсутствовали заместители в бензольных кольцах. Схема этого метода представлена ниже.[15]

Самый универсальный синтез[10] разработан швейцарской командой, впервые задействованной алкилирование из 2,4-динитрохлорбензол с 1-амино-2-диэтиламиноэтаном с образованием N- (β-диэтиламиноэтил) -2,4-динитроанилина [aka: N '- (2,4-динитрофенил) -N, N-диэтилэтан-1,2-диамин ]. 2-нитрозаместитель на 2,4-динитроанилин соединение затем выборочно уменьшенный к соответствующему первичный амин используя сульфид аммония как Восстановитель. Сульфид аммония может быть образован in situ путем добавления концентрированной водной гидроксид аммония с последующим насыщением раствора сероводород газ. Промежуточный продукт, образованный селективным восстановлением 2-нитрозаместителя, 2- (β-диэтиламиноэтиламино) -5-нитроанилин, затем реагирует с гидрохлорид соль иминоэтила эфир 4-этоксифенилацетонитрил (также известный как п-этоксибензилцианид). Иминоэфир, этил 2- (4-этоксифенил) ацетимидиновой кислоты сложный эфир гидрохлорид, получают растворением 4-замещенного бензилцианид в смеси безводный этиловый спирт и хлороформ а затем насыщая этот раствор сухим хлористый водород газ. Реакция между 2- (β-диалкиламиноалкиламином) -5-нитроанилином и HCl-солью иминоэтилового эфира приводит к образованию этонитазена. Эта процедура особенно полезна при получении 4-, 5-, 6- и 7-нитробензимидазолов. Варьируя выбор иминоэфира замещенной фенилуксусной кислоты, можно получить соединения с разнообразием заместителей в бензольном кольце в положении 2. Схема этого конкретного синтеза применительно к получению этонитазена показана ниже.[9]

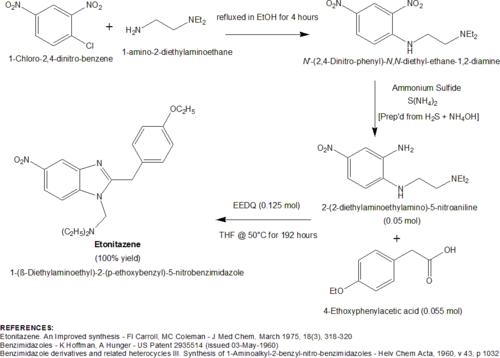
Особенно новый высокоэффективный синтез этонитазена был разработан Ф.И. Кэрроллом и М.К. Коулманом в середине 1970-х годов.[16] Авторам было поручено получить большие количества этонитазена, но они обнаружили, что традиционный синтез неадекватен. Проблемой обычного синтеза была лабильность реагента иминоэфира, этилового эфира 2- (4-этоксифенил) ацетимидиновой кислоты (полученного взаимодействием 4-этоксифенилацетонитрила с этанольным HCl). Иминоэфир потребовал использования безводный условия реакции и было неудобно готовить в больших количествах. Это привело авторов к эксперименту с использованием связывающего реагента, EEDQ (N-Этоксикарбонил-2-этокси-1,2-дигидрохинолин), чтобы способствовать конденсации 2- (2-диэтиламиноэтиламино) -5-нитроанилина с 4-этоксифенилуксусной кислотой. Невероятно, но авторы обнаружили, что, когда эту конденсацию проводили в присутствии 2 или более молярных эквивалентов EEDQ (добавленных порциями в 3 этапа) в THF при 50 ° C в течение 192 часов (8 дней) был получен почти количественный выход (100%) этонитазена. Помимо впечатляющего улучшения урожайности по сравнению с традиционной процедурой, процедура обработки была значительно упрощена, поскольку хинолин, углекислый газ, и этиловый спирт были единственными образовавшимися побочными продуктами. Схема этой процедуры показана ниже.
Публикация 2011 г.[17] [Дж. Орг. Chem., 2011, 76 (23), 9577-9583] из южнокорейской группы в общих чертах описал новый однореакторный синтез замещенных и незамещенных 2-бензилбензимидазолов, который можно легко адаптировать для получения этонитазола. Трехкомпонентный синтез прямого предшественника этонитазена, 2- (4-этоксибензил) -5-нитро-1H-бензоимидазола, состоит из 2-бром- или 2-йод-5-нитрофениламина (1,0 молярный эквивалент), 4-замещенный бензальдегид (1,2 экв.), И азид натрия (2 экв.). 2-Гало-5-нитрофениламин требует наличия бром- или йодной группы для оптимальной активности. 2-Хлорфениламины полностью инертны. В дополнение к этим трем компонентам реакция была оптимизирована в присутствии 0,05 молярных эквивалентов (5 мол.%) Катализатора, хлорида меди (I) и 5 мол.% Лиганда, TMEDA (тетраметилэтилендиамин ). После нагревания этих компонентов при 120 ° C в течение 12 часов в ДМСО, прямой предшественник этонитазена, 2- (4-этоксибензил) -5-нитро-1H-бензоимидазол, образовывался с выходом примерно 80-90%. В вторичный амин Затем азот 2- (4-этоксибензил) -5-нитро-1H-бензоимидазола алкилировали (2-хлорэтил) диэтиламином с образованием этонитазена.[15] Схема этого синтеза показана ниже.

Смотрите также
- Этазен (деснитроэтонитазен)
Рекомендации
- ^ Патент США 2935514, Карл Хоффманн и др., «БЕНЗИМИДАЗОЛЫ», опубликовано 1957-09-19, выпущено 1960-05-03.
- ^ Виклер А., Мартин В. Р., Пескор Ф. Т., Идес К. Г. (октябрь 1963 г.). «Факторы, регулирующие пероральное потребление опиоида (этонитазена) крысами, зависимыми от морфина». Психофармакология. 5 (1): 55–76. Дои:10.1007 / BF00405575. PMID 14082382. S2CID 38073529.
- ^ Сорокин В.И., Понкратов К.В., Дроздов М.А. (1999). «Этонитазен, обнаруженный в Москве». Микрограмм. 32 (9): 239–244.
- ^ Риви П. (3 июня 2003 г.). «Химику предъявлено обвинение в деле о наркотиках». Deseret News. Солт-Лейк-Сити. Архивировано из оригинал 7 марта 2014 г.
- ^ «Этонитазен (этонитазен) - описание препарата» [Этонитазен (этонитазен) - описание препарата] (на русском языке). ООО «Социальные услуги». Архивировано из оригинал 23 марта 2019 г.
- ^ Кишиока С., Ко MC, Вудс Дж. Х. (май 2000 г.). «Дилтиазем усиливает болеутоляющее, но не угнетающее дыхание действие морфина у макак-резусов». Европейский журнал фармакологии. 397 (1): 85–92. Дои:10.1016 / с0014-2999 (00) 00248-х. PMID 10844102.
- ^ Blanckaert P, Cannaert A, Van Uytfanghe K, Hulpia F, Deconinck E, Van Calenbergh S, Stove C. Отчет о новом развивающемся классе сильнодействующих бензимидазольных НПВ опиоидов: химическая и функциональная характеристика изотонитазена in vitro. Анальный тест на наркотики. 2020 Апрель; 12 (4): 422-430. Дои:10.1002 / dta.2738 PMID 31743619
- ^ Vandeputte M, et al. Синтез, химическая характеристика и оценка активности µ-опиоидных рецепторов новой группы нитазеновых синтетических опиоидов. Authorea. 12 ноября 2020. Дои:10.22541 / au.160520665.59016513 / v1
- ^ а б Hunger A, Kebrle J, Rossi A, Hoffmann K (октябрь 1957). «[Синтез анальгетически активных производных бензимидазола с основными замещениями]» [Синтез анальгетически активных производных бензимидазола с основными замещениями]. Experientia. 13 (10): 400–1. Дои:10.1007 / BF02161116. PMID 13473817. S2CID 32179439.
- ^ а б Росси А., Голод А., Кебрле Дж, Хоффманн К. (1960). "Производное бензимидазола и гетероцикл. IV. Конденсация о-фенилендиамина с α-арил- и γ-арил-ацетесигестером" [Производные бензимидазола и родственные гетероциклы IV. Конденсация о-фенилендиамина с α-арилом и γ-арилацетоацетатом]. Helvetica Chimica Acta (на немецком). 43 (4): 1046–1056. Дои:10.1002 / hlca.19600430413.
- ^ Росси А., Голод А., Кебрле Дж, Хоффманн К. (1960). "Производное бензимидазола и гетероцикл V. Die Kondensation von o-Phenylendiamin mit aliphatischen und alicyclischen β-Ketoestern" [Производные бензимидазола и родственные гетероциклы V. Конденсация о-фенилендиамина с алифатическими и алициклическими β-кетоэфирами]. Helvetica Chimica Acta (на немецком). 43 (5): 1298–1313. Дои:10.1002 / hlca.19600430515.
- ^ Голод А., Кебрле Дж, Росси А., Хоффманн К. (1960). "Производное бензимидазола и гетероцикл VI. Синтез из фенил- [1-аминоалкилбензимидазолил- (2)] - эссигсаур-эфир и амиден" [Производные бензимидазола и родственные гетероциклы VI. Синтез эфиров и амидов фенил- [1-аминоалкилбензимидазолил- (2)] уксусной кислоты]. Helvetica Chimica Acta (на немецком). 43 (6): 1727–1733. Дои:10.1002 / hlca.19600430634.
- ^ Голод А., Кебрле Дж, Росси А., Хоффманн К. (1961). "Производное бензимидазола и гетероцикл VII. Synthese neuer 2-амино-бензимидазол" [Производные бензимидазола и родственные гетероциклы VII. Синтез нового 2-аминобензимидазола. Helvetica Chimica Acta (на немецком). 44 (5): 1273–1282. Дои:10.1002 / hlca.19610440513.
- ^ Гросс Ф., Турриан Х (октябрь 1957 г.). «[Производные бензимидазола с сильным обезболивающим действием]» [Производные бензимидазола с сильным обезболивающим действием]. Experientia. 13 (10): 401–3. Дои:10.1007 / BF02161117. PMID 13473818. S2CID 6824038.
- ^ а б Голод А., Кебрле Дж, Росси А., Хоффманн К. (1960). "Производное бензимидазола и гетероцикл. II. Синтез 1-аминоалкил-2-бензил-бензимидазолена" [Производные бензимидазола и родственные гетероциклы II. Синтез 1-аминоалкил-2-бензилбензимидазолов. Helvetica Chimica Acta (на немецком). 43 (3): 800–809. Дои:10.1002 / hlca.19600430323.
- ^ Кэрролл FI, Coleman MC (март 1975 г.). «Этонитазен. Улучшенный синтез». Журнал медицинской химии. 18 (3): 318–20. Дои:10.1021 / jm00237a024. PMID 237125.
- ^ Ким И, Кумар MR, Пак Н, Хео И, Ли С. (декабрь 2011 г.). «Катализируемый медью однореакторный трехкомпонентный синтез бензимидазолов путем конденсации и образования связи C-N». Журнал органической химии. 76 (23): 9577–83. Дои:10.1021 / jo2019416. PMID 22034860.
