Мупироцин - Mupirocin
 | |
 Псевдомоновая кислота A (PA-A), основной компонент мупироцина | |
| Клинические данные | |
|---|---|
| Торговые наименования | Бактробан, другие |
| Другие имена | муципроцин[1] |
| AHFS /Drugs.com | Монография |
| MedlinePlus | a688004 |
| Данные лицензии | |
| Беременность категория |
|
| Маршруты администрация | Актуальные |
| Код УВД | |
| Легальное положение | |
| Легальное положение | |
| Фармакокинетический данные | |
| Связывание с белками | 97% |
| Устранение период полураспада | От 20 до 40 минут |
| Идентификаторы | |
| |
| Количество CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| КЕГГ | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| Панель управления CompTox (EPA) | |
| ECHA InfoCard | 100.106.215 |
| Химические и физические данные | |
| Формула | C26ЧАС44О9 |
| Молярная масса | 500.629 г · моль−1 |
| 3D модель (JSmol ) | |
| Температура плавления | От 77 до 78 ° C (от 171 до 172 ° F) |
| |
| |
| | |
Мупироцин, продается под торговой маркой Бактробан среди прочего, актуален антибиотик полезно против поверхностных кожные инфекции Такие как импетиго или же фолликулит.[3][4][5] Его также можно использовать для избавления от метициллин-устойчивый S. aureus (MRSA) при попадании в нос без симптомов.[4] В связи с проблемами развития сопротивление, не рекомендуется использовать более десяти дней.[5] Он используется в виде крема или мази для нанесения на кожу.[4]
Общие побочные эффекты включают зуд и сыпь в месте нанесения, головную боль и тошноту.[4] Длительное использование может привести к увеличению роста грибы.[4] Использовать во время беременность и кормление грудью кажется безопасным.[4] Мупироцин находится в карбоновая кислота класс лекарств.[6] Он работает, блокируя способность бактерий производить белок, что обычно приводит к бактериальная смерть.[4]
Мупироцин был первоначально выделен в 1971 г. Pseudomonas fluorescens.[7] Это на Список основных лекарственных средств Всемирной организации здравоохранения.[8] В 2017 году это было 186-е место среди наиболее часто назначаемых лекарств в Соединенных Штатах: было выписано более трех миллионов рецептов.[9][10]
Медицинское использование

Мупироцин используется в качестве местного лечения бактериальных инфекций кожи, например, фурункул, импетиго, открытые раны, которые обычно возникают в результате инфицирования Золотистый стафилококк или же Streptococcus pyogenes. Это также полезно при лечении поверхностных метициллин-устойчивый Золотистый стафилококк (MRSA) инфекции.[11] Мупироцин неактивен в отношении большинства анаэробных бактерий, микобактерий, микоплазм, хламидий, дрожжей и грибов.[12]
Интраназальный прием мупироцина перед операцией эффективен для предотвращения инфицирования послеоперационной раны Золотистый стафилококк а профилактическое интраназальное лечение или лечение в месте катетера эффективно для снижения риска инфекции в месте катетера у лиц, получающих хронический перитонеальный диализ.[13]
Сопротивление
Вскоре после начала клинического применения мупироцина штаммы Золотистый стафилококк это были стойкий к появлению мупироцина, с ноздри показатели успеха менее 30%.[14][15] Две разные популяции устойчивых к мупироцину S. aureus были изолированы. Один штамм обладал низким уровнем устойчивости, MuL, (MIC = 8–256 мг / л), а другой обладал высокой устойчивостью, MuH (МПК> 256 мг / л).[14] Устойчивость штаммов MuL, вероятно, связана с мутации в организме дикого типа изолейцил-тРНК синтетаза. В Кишечная палочка IleRS, мутация одной аминокислоты изменяет устойчивость к мупироцину.[16] MuH связан с приобретением отдельного гена синтетазы Ile, MupA.[17] Мупироцин не является эффективным антибиотиком против штаммов MuH. Другие антибиотики, такие как азелаиновая кислота, нитрофуразон, сульфадиазин серебра, и рамопланин было показано, что они эффективны против штаммов MuH.[14]
Большинство штаммов Cutibacterium acnes, возбудитель кожного заболевания юношеские угри, обладают естественной устойчивостью к мупироцину.[18]
Механизм действия мупироцина отличается от других клинических антибиотиков, оказывая перекрестное сопротивление к другим антибиотикам маловероятно.[14] Однако ген MupA может совместная передача с другими генами антибактериальной устойчивости. Это уже наблюдалось с генами устойчивости к триклозан, тетрациклин, и триметоприм.[14] Это также может привести к чрезмерному росту нечувствительных организмов.
Механизм действия
Псевдомоновая кислота ингибирует изолейцин-тРНК-синтетазу в бактериях,[11] что приводит к истощению изолейцил-тРНК и накоплению соответствующей незаряженной тРНК. Истощение изолейцил-тРНК приводит к подавление синтеза белка. Незаряженная форма тРНК связывается с сайтом связывания аминоацил-тРНК рибосом, запуская образование (p) ppGpp, что, в свою очередь, подавляет синтез РНК.[19] Комбинированное ингибирование синтеза белка и синтеза РНК приводит к бактериостазу. Этот механизм действия характерен для фураномицин, аналог изолейцина.[20]
Биосинтез
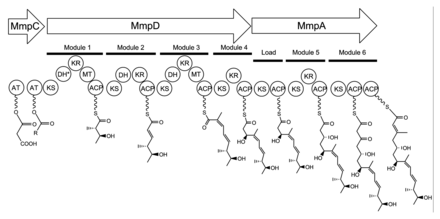



Мупироцин представляет собой смесь нескольких псевдомоновых кислот, причем псевдомоновая кислота A (PA-A) составляет более 90% смеси. В мупироцине также присутствует псевдомоновая кислота B с дополнительным гидроксильная группа в C8,[23] псевдомоновая кислота C с двойная связь между C10 и C11 вместо эпоксид ПА-А,[24] и псевдомоновая кислота D с двойной связью у C4 'и C5' в части 9-гидроксинонановой кислоты мупироцина.[25]
Биосинтез псевдомоновой кислоты А
74 kb мупироцин кластер генов содержит шесть многодоменный ферменты и двадцать шесть других пептиды (Таблица 1).[21] Четыре больших многодоменных типа I поликетидсинтаза (PKS) кодируются белки, а также несколько однофункциональных ферментов с последовательностью, сходной с PKS типа II.[21] Следовательно, считается, что мупироцин сконструирован с помощью смешанной системы ПКС типа I и типа II. Кластер мупироцина проявляет нетипичный ацилтрансфераза (AT), поскольку существует только два домена AT, и оба они обнаружены в одном и том же белке MmpC. Эти домены AT являются единственными доменами, присутствующими на MmpC, тогда как другие три белка PKS типа I не содержат доменов AT.[21] Путь мупироцина также содержит несколько тандемных белок-носитель ацила дублеты или тройки. Это может быть адаптация для увеличения производительности или одновременного связывания нескольких субстратов.[21]
Псевдомоновая кислота А является продуктом этерификация между поликетидмониевой кислотой 17C и 9C жирная кислота 9-гидрокси-нонановая кислота. Возможность того, что вся молекула собрана как единый поликетид с Байер-Виллигер окисление вставка кислород в углеродный каркас был исключен, потому что C1 мониновой кислоты и C9 '9-гидроксинонановой кислоты оба являются производными C1 ацетата.[26]
| Ген | Функция |
|---|---|
| mupA | FMN ЧАС2 зависимая оксигеназа |
| mmpA | KS ACP KS KR ACP KS ACP ACP |
| mupB | 3-оксоацил-ACP синтаза |
| mmpB | KS DH KR ACP ACP ACP TE |
| mmpC | В В |
| mmpD | KS DH KR Встретились ACP KS DH KR ACP KS DH KR MeT ACP KS KR ACP |
| mupC | НАДН /НАДФН оксидоредуктаза |
| macpA | ACP |
| mupD | 3-оксоацил-ACP редуктаза |
| mupE | еноилредуктаза |
| macpB | ACP |
| mupF | KR |
| macpC | ACP |
| mupG | 3-оксоацил-ACP синтаза I |
| mupH | HMG-CoA синтаза |
| mupJ | еноил-КоА гидратаза |
| mupK | еноил-КоА гидратаза |
| mmpE | KS гидролаза |
| mupL | предполагаемая гидролаза |
| mupM | изолейцил-тРНК синтаза |
| mupN | фосфопантетеинил трансфераза |
| mupO | цитохром P450 |
| mupP | неизвестный |
| mupQ | ацил-КоА-синтаза |
| mupS | 3-оксоацил-ACP редуктаза |
| macpD | ACP |
| mmpF | KS |
| macpE | ACP |
| mupT | ферредоксин диоксигеназа |
| mupU | ацил-КоА-синтаза |
| mupV | оксидоредуктаза |
| mupW | диоксигеназа |
| mupR | Н-АХЛ -отзывчивый активатор транскрипции |
| mupX | амидаза / гидролаза |
| mupI | N-AHL синтаза |
Биосинтез мониновой кислоты
Биосинтез единицы мониновой кислоты 17C начинается на MmpD (рис. 1).[21] Один из доменов AT от MmpC может переносить активированную ацетильную группу от ацетил-кофермента A (CoA) к первому домену ACP. Цепь удлиняется малонил-КоА, за которым следует SAM-зависимый метилирование на C12 (см. рисунок 2 для нумерации PA-A) и восстановление B-кетогруппы до спирта. Предполагается, что домен дегидратации (DH) в модуле 1 будет нефункциональным из-за мутации в консервированный активный сайт область, край. Модуль 2 добавляет еще два атома углерода с помощью блока разбавителя малонил-КоА, после чего следует кетовосстановление (KR) и дегидратация. В третьем модуле добавлен блок-удлинитель малонил-КоА, за которым следует SAM-зависимое метилирование по C8, кеторедукция и дегидратация. Модуль 4 расширяет молекулу единицей малонил-КоА с последующим кетовосстановлением.
Сборку мониновой кислоты продолжают переносом продукта 12C MmpD в MmpA.[21] Еще два раунда расширения с помощью единиц малонил-КоА достигаются модулями 5 и 6. Модуль 5 также содержит домен KR.
Пост-ПКС пошив одежды
Кетогруппа у C3 заменяется метильной группой в многостадийной реакции (рис. 3). MupG начинается с декарбоксилирование малонил-АСР. В альфа-углерод образующегося ацетил-АСР связан с С3 поликетидной цепи посредством MupH. Этот промежуточный продукт дегидратируется и декарбоксилируется MupJ и MupK соответственно.[21]
Формирование пиран кольцо требует многих ферментно-опосредованных шагов (рис. 4). Предполагается, что двойная связь между C8 и C9 перемещается между C8 и C16.[22] Джин нокаут эксперименты с mupO, mupU, mupV и macpE устранили производство PA-A.[22] Эти нокауты не удаляют продуцирование PA-B, демонстрируя, что PA-B не создается гидроксилированием PA-A. Нокаут mupW устраняет пирановое кольцо, идентифицируя MupW как участвующий в образовании кольца.[22] Неизвестно, происходит ли это до или после этерификация моновой кислоты в 9-гидроксинонановую кислоту.
В эпоксид PA-A в C10-11, как полагают, вставляется после образования пирана посредством цитохром P450 такие как MupO.[21] Нокаут гена mupO прекратил производство PA-A, но PA-B, который также содержит эпоксид C10-C11, остался.[22] Это указывает на то, что MupO либо не участвует, либо не является существенным для этого этапа эпоксидирования.
Биосинтез 9-гидроксинонановой кислоты
Девять углерода жирная кислота 9-гидрокси-нонановая кислота (9-HN) образуется в виде отдельного соединения, а затем этерифицируется до моновой кислоты с образованием псевдомоновой кислоты. 13С маркировкой ацетат кормление показало, что C1-C6 сконструированы с ацетатом каноническим образом синтез жирных кислот. C7 'показывает только C1-мечение ацетата, в то время как C8' и C9 'показывают обратную картину ацетата, меченного 13C.[26] Предполагается, что C7-C9 возникает из 3-гидроксипропионатного стартового звена, которое трижды удлиняется малонил-КоА и полностью восстанавливается с образованием 9-HN. Также предполагалось, что 9-HN инициируется 3-гидрокси-3-метилглутаровой кислотой (HMG). Эта последняя теория не была подтверждена кормлением [3-14C] или [3,6-13C2] -HMG.[27]
Предполагается, что MmpB катализирует синтез 9-HN (Рисунок 5). MmpB содержит KS, KR, DH, 3 ACP и домен тиоэстеразы (TE).[21] Он не содержит домена еноилредуктазы (ER), который необходим для полного восстановления до девятиуглеродной жирной кислоты. MupE представляет собой однодоменный белок, который демонстрирует сходство последовательностей с известными доменами ER и может завершить реакцию.[21] Также остается возможным, что 9-гидроксинонановая кислота частично или полностью образована вне кластера мупироцина.
Рекомендации
- ^ Флейшер, Алан Б. (2002). Неотложная дерматология: руководство по быстрому лечению. McGraw Hill Professional. п. 173. ISBN 9780071379953. В архиве из оригинала от 10.09.2017.
- ^ "Онлайн-запрос к базе данных лекарственных препаратов". health-products.canada.ca. Получено 30 июля 2019.
- ^ AlHoufie, Sari Talal S .; Фостер, Ховард А. (1 августа 2016 г.). «Влияние сублетальных концентраций мупироцина на глобальную транскрипцию Staphylococcus aureus 8325-4 и модель ухода от ингибирования». Журнал медицинской микробиологии. 65 (8): 858–866. Дои:10,1099 / мм 0,000270. PMID 27184545.
- ^ а б c d е ж грамм «Мупироцин». Американское общество фармацевтов систем здравоохранения. В архиве из оригинала 21 декабря 2016 г.. Получено 8 декабря 2016.
- ^ а б Всемирная организация здоровья (2009). Стюарт М.С., Куимци М., Хилл С.Р. (ред.). Типовой формуляр ВОЗ 2008 г.. Всемирная организация здоровья. п. 298. HDL:10665/44053. ISBN 9789241547659.
- ^ Ханна, Рамеш; Krediet, Раймонд Т. (2009). Учебник Нольфа и Гокала по перитонеальному диализу (3-е изд.). Springer Science & Business Media. п. 421. ISBN 9780387789408. В архиве из оригинала от 10.09.2017.
- ^ Хеггерс, Джон П .; Робсон, Мартин С .; Филлипс, Линда Г. (1990). Количественная бактериология: ее роль в арсенале хирурга. CRC Press. п. 118. ISBN 9780849351297. В архиве из оригинала от 10.09.2017.
- ^ Всемирная организация здоровья (2019). Типовой список основных лекарственных средств Всемирной организации здравоохранения: 21-й список 2019 г.. Женева: Всемирная организация здравоохранения. HDL:10665/325771. WHO / MVP / EMP / IAU / 2019.06. Лицензия: CC BY-NC-SA 3.0 IGO.
- ^ «ТОП-300 2020». ClinCalc. Получено 11 апреля 2020.
- ^ «Мупироцин - статистика употребления наркотиков». ClinCalc. Получено 11 апреля 2020.
- ^ а б Хьюз Дж., Меллоуз Дж. (Октябрь 1978 г.). «Ингибирование изолейцил-синтетазы рибонуклеиновой кислоты в Echerichia coli псевдомоновой кислотой». Biochem. J. 176 (1): 305–18. Дои:10.1042 / bj1760305. ЧВК 1186229. PMID 365175.
- ^ «Монография продукта Бактробан» (PDF). В архиве (PDF) с оригинала 24 сентября 2015 г.. Получено 8 сентября, 2014.
- ^ Troeman DPR, Van Hout D, Kluytmans JAJW (февраль 2019 г.). «Антимикробные подходы в профилактике инфекций Staphylococcus aureus: обзор». J. Antimicrob. Chemother. 74 (2): 281–294. Дои:10.1093 / jac / dky421. ЧВК 6337897. PMID 30376041.
- ^ а б c d е Cookson BD (январь 1998 г.). «Возникновение устойчивости к мупироцину: вызов инфекционному контролю и практике назначения антибиотиков». J. Antimicrob. Chemother. 41 (1): 11–8. Дои:10.1093 / jac / 41.1.11. PMID 9511032.
- ^ Вустер, Шарон (март 2008 г.). «Актуальная деколонизация MRSA необходима во время вспышек». Американский колледж врачей скорой помощи. Elsevier Global Medical News. В архиве из оригинала 18 мая 2014 г.. Получено 18 ноября 2013.
- ^ Янагисава Т., Ли Дж. Т., Ву ХК, Каваками М. (сентябрь 1994 г.). «Связь белковой структуры изолейцил-тРНК синтетазы с устойчивостью к псевдомоновой кислоте Escherichia coli. Предлагаемый способ действия псевдомоновой кислоты в качестве ингибитора изолейцил-тРНК синтетазы». J. Biol. Chem. 269 (39): 24304–9. PMID 7929087.
- ^ Гилбарт Дж., Перри Ч.Р., Слокомб Б. (январь 1993 г.). «Высокий уровень устойчивости к мупироцину у Staphylococcus aureus: данные о двух различных изолейцил-тРНК синтетаз». Антимикробный. Агенты Chemother. 37 (1): 32–8. Дои:10.1128 / aac.37.1.32. ЧВК 187600. PMID 8431015.
- ^ «Чувствительность к антибиотикам Propionibacterium acnes». ScienceOfAcne.com. 2011-06-11. В архиве из оригинала от 29.07.2012. Получено 2012-08-27.
- ^ Haseltine WA, Блок R (май 1973 г.). «Синтез гуанозинтетра- и пентафосфата требует присутствия кодон-специфичной незаряженной переносящей рибонуклеиновой кислоты в акцепторном сайте рибосом». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 70 (5): 1564–8. Bibcode:1973PNAS ... 70.1564H. Дои:10.1073 / пнас.70.5.1564. ЧВК 433543. PMID 4576025.
- ^ Танака К., Тамаки М., Ватанабе С. (ноябрь 1969 г.). «Влияние фураномицина на синтез изолейцил-тРНК». Биохим. Биофиз. Acta. 195 (1): 244–5. Дои:10.1016/0005-2787(69)90621-2. PMID 4982424.
- ^ а б c d е ж грамм час я j k Эль-Сайед А.К., Хотерсолл Дж., Купер С.М., Стивенс Э., Симпсон Т.Дж., Томас С.М. (май 2003 г.). «Характеристика кластера генов биосинтеза мупироцина из Pseudomonas fluorescens NCIMB 10586». Chem. Биол. 10 (5): 419–30. Дои:10.1016 / S1074-5521 (03) 00091-7. PMID 12770824.
- ^ а б c d е Купер С.М., Лаосрипайбун В., Рахман А.С. и др. (Июль 2005 г.). «Переход к продукции псевдомоновой кислоты B в P. fluorescens NCIMB10586 путем мутации генов адаптации мупироцина mupO, mupU, mupV и macpE». Chem. Биол. 12 (7): 825–33. Дои:10.1016 / j.chembiol.2005.05.015. PMID 16039529.
- ^ Цепь EB, Mellows G (1977). «Псевдомоновая кислота. Часть 3. Строение псевдомоновой кислоты Б». J. Chem. Soc. Perkin Trans. 1 (3): 318–24. Дои:10,1039 / п19770000318. PMID 402373.
- ^ Клейтон, Дж; О'Хэнлон, Питер Дж .; Роджерс, Норман Х. (1980). «Строение и конфигурация псевдомоновой кислоты C». Буквы Тетраэдра. 21 (9): 881–884. Дои:10.1016 / S0040-4039 (00) 71533-4.
- ^ О'Хэнлон, П.Дж.; Роджерс, штат Нью-Хэмпшир; Тайлер, JW (1983). «Химия псевдомоновой кислоты. Часть 6. Строение и получение псевдомоновой кислоты D». Журнал химического общества, Perkin Transactions 1: 2655–2657. Дои:10.1039 / P19830002655.
- ^ а б Кошачий TC, Джонс Р.Б., Меллоуз Г., Филлипс Л. (1977). «Псевдомоновая кислота. Часть 2. Биосинтез псевдомоновой кислоты А». J. Chem. Soc. Perkin Trans. 1 (3): 309–18. Дои:10,1039 / п19770000309. PMID 402372.
- ^ Мартин, FM; Симпсон, Т.Дж. (1989). «Биосинтетические исследования псевдомоновой кислоты (мупироцина), нового метаболита антибиотика Pseudomonas fluorescens». Журнал химического общества, Perkin Transactions 1 (1): 207–209. Дои:10.1039 / P19890000207.
