Саксаглиптин - Saxagliptin
 | |
| Клинические данные | |
|---|---|
| Торговые наименования | Онглиза |
| Другие имена | BMS-477118 |
| AHFS /Drugs.com | Информация о лекарствах для потребителей |
| MedlinePlus | a610003 |
| Данные лицензии |
|
| Маршруты администрация | В рот (таблетки ) |
| Код УВД | |
| Легальное положение | |
| Легальное положение | |
| Фармакокинетический данные | |
| Биодоступность | ~ 75% (ТМаксимум = 2 ч) |
| Связывание с белками | незначительный |
| Метаболизм | Печеночная (CYP3A4 и CYP3A5 ) |
| Устранение период полураспада | 2,5 ч (саксаглиптин), 3,1 ч (основной метаболит) |
| Экскреция | 22% (Желчь ), 75% (Моча ) |
| Идентификаторы | |
| |
| Количество CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| ЧЭМБЛ | |
| Панель управления CompTox (EPA) | |
| Химические и физические данные | |
| Формула | C18ЧАС25N3О2 |
| Молярная масса | 315.417 г · моль−1 |
| 3D модель (JSmol ) | |
| |
| |
| | |
Саксаглиптин, продается под торговой маркой Онглиза, является пероральным гипогликемическим средством (антидиабетический препарат ) из ингибитор дипептидилпептидазы-4 (ДПП-4) класс.[1][2] Ранняя разработка была исключительно Бристоль-Майерс Сквибб; в 2007 АстраЗенека объединилась с Bristol-Myers Squibb для совместной разработки конечного соединения и сотрудничества в маркетинге препарата.
В апреле 2016 года FDA США добавило предупреждение о повышенном риске сердечная недостаточность.[3] Это было основано на данных в статье, в которой был сделан вывод: «Ингибирование DPP-4 саксаглиптином не увеличивало или не снижало частоту ишемических событий, хотя частота госпитализаций по поводу сердечной недостаточности была увеличена. Хотя саксаглиптин улучшает гликемический контроль, необходимы другие подходы для снизить риск сердечно-сосудистых заболеваний у пациентов с диабетом ».[4]
Медицинское использование
Саксаглиптин используется как монотерапия или в комбинации с другими препаратами для лечения диабета 2 типа. Похоже, что это не снижает риск сердечные приступы или удары.[4] Это увеличивает риск госпитализации по поводу сердечной недостаточности примерно на 27%. Как и другие ингибиторы DPP-4, он обладает относительно умеренной способностью снижать HbA1c, связан с относительно низким риском гипогликемии и не вызывает увеличения веса.[4][5]
Саксаглиптин улучшил среднее HbA1c уровни (относительно плацебо) в 24-недельном испытании у людей с диабетом 2 типа.[6] Комбинированная терапия саксаглиптином и метформином была более эффективной, чем монотерапия саксаглиптином или метформином.[6] Когда относительная польза от увеличения дозы сульфонилмочевина или добавление саксаглиптина оценивалось в исследовании с участием 768 пациентов; было показано, что комбинированное лечение оказывает значительно большее влияние на уровень глюкозы в крови натощак, чем увеличение дозы только тестируемого глибенкламида.[7]
Побочные эффекты
В тех, кто принимает сульфонилмочевины есть повышенный риск низкий уровень сахара в крови.[8]
3 побочные реакции наблюдались чаще при приеме саксаглиптина по сравнению с плацебо. Таблица 1: Побочные реакции (независимо от оценки причинно-следственной связи исследователем) в плацебо-контролируемых исследованиях * Сообщалось о ≥ 5% пациентов, получавших ONGLYZA (таблетки саксаглиптина) в дозе 5 мг и чаще, чем у пациентов, получавших плацебо.[9]
| ОНГЛИЗА 5 мг N = 882 | Плацебо N = 799 | |
|---|---|---|
| Инфекция верхних дыхательных путей | 68 (7.7) | 61 (7.6) |
| Инфекция мочевыводящих путей | 60 (6.8) | 49 (6.1) |
| Головная боль | 57 (6.5) | 47 (5.9)[9] |
- Пять плацебо-контролируемых испытаний включают два испытания монотерапии и одно испытание дополнительной комбинированной терапии с каждым из следующих препаратов: метформин, тиазолидиндион или глибурид. В таблице приведены данные за 24 недели независимо от гликемического восстановления.[9]
В феврале 2012 г. компания Bristol-Myers / Astra Zeneca распространила дополнительную информацию о безопасности при использовании саксаглиптина в Южной Африке. Вкладыш в упаковку подлежит редактированию для Южной Африки. Противопоказания теперь будут включать в себя анамнез чувствительности к саксаглиптину (или другому ингибитору DPP4), а также панкреатит. Спонтанно сообщаемые нежелательные явления в Южной Африке включают анафилаксию, ангионевротический отек и острый панкреатит.
В исследовании сердечно-сосудистых исходов лечение саксаглиптином позволило незначительно увеличить риск госпитализации по поводу сердечной недостаточности.[4] Саксаглиптин может вызывать боль в суставах, которая может быть серьезной и приводить к инвалидности.[10] Саксаглиптин может увеличить риск сердечной недостаточности.[11]
Переносимость
В клинических испытаниях как монотерапия, так и комбинированная терапия с другими агентами в целом хорошо переносились.[6]
Панкреатит и рак поджелудочной железы
Была предложена ассоциация класса ингибиторов DPP-IV с проблемами поджелудочной железы, в основном на основании сообщений о случаях, связанных с ингибитором DPP-IV ситаглиптином и несколькими миметиками инкретина, включая экзенатид. В исследовании 2013 года, посвященном ингибитору ДПП-4 ситаглиптину, сообщалось, что были обнаружены «тревожные изменения в поджелудочной железе крыс, которые могут привести к раку поджелудочной железы».[12] Во второй статье тех же авторов сообщается об увеличении предраковых поражений поджелудочной железы у доноров органов, которые принимали ингибиторы GLP-1.[13] В ответ на эти отчеты, FDA США и Европейское агентство по лекарственным средствам провели независимые обзоры всех клинических и доклинических данных, касающихся возможной связи ингибиторов DPP-IV с раком поджелудочной железы. В совместном письме в New England Journal of Medicines агентства заявили, что «Оба агентства согласны с тем, что утверждения о причинной связи между препаратами на основе инкретина и панкреатитом или раком поджелудочной железы, высказанные недавно в научной литературе и средствах массовой информации, являются несовместимы с текущими данными. FDA и EMA в настоящее время не пришли к окончательному выводу относительно такой причинно-следственной связи. Хотя совокупность данных, которые были проанализированы, дает уверенность, панкреатит будет по-прежнему рассматриваться как связанный с ними риск наркотиков, пока не будет больше данных; оба агентства продолжают исследовать этот сигнал безопасности ».[14]
Были поданы иски, в которых истцы, у которых развился рак поджелудочной железы, утверждали, что ингибиторы DPP-IV или инкретины играли причинную роль в развитии их рака.[15][16]
Производство
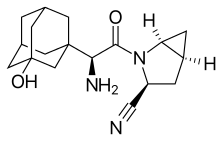
Синтез саксаглиптина компанией Bristol-Myers Squibb путем амидного сочетания N-Boc-3-гидроксиадамантилглицина (2) и метанопролинамид (3) с участием EDC. Первый коммерчески доступен, тогда как последний доступен как аналог N-Boc. Затем пролинеамидный фрагмент дегидратируют трифторуксусный ангидрид с получением цианида в виде сложного эфира трифторацетата, который подвергается гидролизу. Удаление Boc защитная группа с последующей нейтрализацией дает желаемый продукт (1):[17]
Фармакология
Саксаглиптин является частью класса лекарств от диабета, называемых дипептидилпептидаза-4 Ингибиторы (DPP-4). DPP-4 - это фермент, который расщепляет инкретин гормоны. Как Ингибитор ДПП-4, саксаглиптин замедляет распад инкретиновых гормонов, повышая уровень этих гормонов в организме. Именно это увеличение инкретиновых гормонов отвечает за полезные действия саксаглиптина, включая увеличение выработки инсулина в ответ на прием пищи и снижение скорости глюконеогенез в печени.[18]
Роль дипептидилпептидазы-4 в глюкоза в крови считается, что регулирование происходит через деградацию GIP[19] и деградация GLP-1.[19][20]
Поскольку инкретиновые гормоны более активны в ответ на более высокий уровень сахара в крови (и менее активны в ответ на низкий уровень сахара в крови), риск опасно низкого уровня сахара в крови (гипогликемии) низкий при монотерапии саксаглиптином.
Лицензирование
Заявка на новый лекарственный препарат саксаглиптина для лечения диабета 2 типа была подана в FDA в июне 2008 года. Она была основана на программе разработки лекарств с 8 рандомизированными испытаниями: 1 фаза 2 исследование диапазона доз (2,5–100 мг / сут). ; 6 фаз 3, 24-недельные контролируемые испытания с дополнительным контролируемым периодом наблюдения от 12 до 42 месяцев, двойным слепым методом на всем протяжении; и одно 12-недельное испытание механизма действия с 2-летним периодом наблюдения.[21] 31 июля 2009 г. FDA одобрило саксаглиптин под торговой маркой Onglyza.[22]Саксаглиптин был лицензирован для использования на всей территории Европейского Союза Европейским агентством по лекарственным средствам 1 декабря 2009 года.[23]27 декабря 2006 г. компания Bristol-Myers Squibb объявила, что Otsuka Pharmaceutical Co. получил эксклюзивные права на разработку и коммерциализацию комплекса в Японии. В соответствии с лицензионным соглашением Otsuka будет нести все расходы на разработку, но Bristol-Myers Squibb сохраняет за собой права на совместное продвижение саксаглиптина с Otsuka в Японии.[24] Кроме того, 11 января 2007 г. было объявлено, что Bristol-Myers Squibb и АстраЗенека будут работать вместе, чтобы завершить разработку препарата и его последующий маркетинг.[25]
Смотрите также
использованная литература
- ^ Augeri D; и другие. (2005). «Открытие и доклинический профиль саксаглиптина (BMS-477118): высокоэффективного, длительного действия, перорально активного ингибитора дипептидилпептидазы IV для лечения диабета 2 типа». Журнал медицинской химии. 48 (15): 5025–5037. Дои:10.1021 / jm050261p. PMID 16033281.
- ^ «Бристоль, компания Takeda Drugs предлагает альтернативы Januvia (Update2)». Bloomberg. 2008-06-07.
- ^ «Предупреждения о безопасности медицинских продуктов для людей - лекарства от диабета, содержащие саксаглиптин и алоглиптин: информация о безопасности лекарств - риск сердечной недостаточности». www.fda.gov. Получено 7 апреля 2016.
- ^ а б c d Scirica, BM; Bhatt, DL; Браунвальд, Э; Steg, PG; Дэвидсон, Дж; Хиршберг, Б; Ohman, P; Frederich, R; Wiviott, SD; Hoffman, EB; Кавендер, Массачусетс; Udell, JA; Desai, NR; Mosenzon, O; Макгуайр, ДК; Ray, KK; Leiter, LA; Раз, I (3 октября 2013 г.). «Саксаглиптин и сердечно-сосудистые исходы у пациентов с сахарным диабетом 2 типа» (PDF). Медицинский журнал Новой Англии. 369 (14): 1317–1326. Дои:10.1056 / nejmoa1307684. HDL:10044/1/40070. PMID 23992601.
- ^ Али С; Fonseca V (январь 2013 г.). «Обзор саксаглиптина: особое внимание уделяется безопасности и побочным эффектам». Эксперт Opin Drug Saf. 12 (1): 103–9. Дои:10.1517/14740338.2013.741584. PMID 23137182.
- ^ а б c Диллон, S; Вебер, Дж. (2009). «Саксаглиптин». Наркотики. 69 (15): 2103–2114. Дои:10.2165/11201170-000000000-00000. PMID 19791828.
- ^ «Новые препараты: саксаглиптин». Австралийский врач (34): 89–91. Июнь 2011 г.
- ^ Сальво, Франческо; Мур, Николас; Арно, Микаэль; Робинсон, Филипп; Раши, Эмануэль; Де Понти, Фабрицио; Бего, Бернар; Париенте, Антуан (3 мая 2016 г.). «Добавление ингибиторов дипептидилпептидазы-4 к препаратам сульфонилмочевины и риск гипогликемии: систематический обзор и метаанализ». BMJ. 353: i2231. Дои:10.1136 / bmj.i2231. ЧВК 4854021. PMID 27142267.
- ^ а б c «Онглиза». RxList. Получено 2012-01-31.
- ^ «Ингибиторы DPP-4 при диабете 2 типа: информация о безопасности лекарств - может вызывать сильную боль в суставах». Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA). 2015-08-28. Получено 1 сентября 2015.
- ^ «Сообщение FDA по безопасности лекарств: FDA добавляет предупреждения о риске сердечной недостаточности на этикетки лекарств от диабета 2 типа, содержащих саксаглиптин и алоглиптин». НАС. Управление по контролю за продуктами и лекарствами (FDA). 12 января 2017 г.. Получено 11 августа 2020.
- ^ Матвеенко А.В., Драй С., Кокс Н.И. и др. (Июль 2009 г.). «Благоприятные эндокринные, но неблагоприятные экзокринные эффекты ситаглиптина в модели сахарного диабета 2 типа на трансгенных крысах из островкового амилоидного полипептида человека: взаимодействие с метформином». Сахарный диабет. 58 (7): 1604–15. Дои:10.2337 / db09-0058. ЧВК 2699878. PMID 19403868.
- ^ Батлер А.Е., Кэмпбелл-Томпсон М., Гурло Т., Доусон Д.В., Аткинсон М., Батлер П.С. (июль 2013 г.). «Заметное расширение экзокринной и эндокринной поджелудочной железы с помощью инкретиновой терапии у людей с повышенной экзокринной дисплазией поджелудочной железы и потенциалом глюкагон-продуцирующих нейроэндокринных опухолей». Сахарный диабет. 62 (7): 2595–604. Дои:10.2337 / db12-1686. ЧВК 3712065. PMID 23524641.
- ^ Иган, Эми Дж .; Слепой, Эберхард; Дандер, Кристина; De Graeff, Pieter A .; Хаммер, Б. Тимоти; Бурсье, Тодд; Rosebraugh, Кертис (2014). "Панкреатическая безопасность препаратов на основе инкретина - оценка FDA и EMA - NEJM" (PDF). Медицинский журнал Новой Англии. 370 (9): 794–7. Дои:10.1056 / NEJMp1314078. PMID 24571751.
- ^ «Последние судебные иски Januvia о помощи в связи с раком поджелудочной железы: Resource4thePeople сообщает о том, что дела продолжают подаваться в федеральные мультирайонные судебные тяжбы». DG. DigitalJournal.com. 14 октября 2013 г.. Получено 2013-10-14.
- ^ "IN RE: INCRETIN MIMETICS PRODUCTS ТРЕБОВАНИЯ ОБ ОТВЕТСТВЕННОСТИ" (PDF). USJP. Судебная коллегия США по многосторонним судебным спорам. 26 августа 2013 г.. Получено 2013-08-26.
- ^ Скотт А.С., Грегори С.Дж., Сергей К., Шелли А.Р., Трук V, Роберт Э.В. (2009). «Приготовление саксаглиптина, нового ингибитора DPP-IV». Орг. Процесс Res. Dev. 13 (6): 1169–1176. Дои:10.1021 / op900226j.
- ^ [1] Информация о диабете
- ^ а б Mentlein, R; Гальвиц, B; Шмидт, WE (15 июня 1993 г.). «Дипептидил-пептидаза IV гидролизует желудочный ингибирующий полипептид, глюкагоноподобный пептид-1 (7-36) амид, пептид гистидин-метионин и отвечает за их разложение в сыворотке человека». Европейский журнал биохимии. 214 (3): 829–835. Дои:10.1111 / j.1432-1033.1993.tb17986.x. PMID 8100523.
- ^ Арен, Бо; Ландин-Ольссон, Мона; Янссон, Пер-Андерс; Свенссон, Мария; Холмс, Дэвид; Швейцер, Аня (май 2004 г.). «Ингибирование дипептидилпептидазы-4 снижает гликемию, поддерживает уровни инсулина и снижает уровни глюкагона при диабете 2 типа». Журнал клинической эндокринологии и метаболизма. 89 (5): 2078–2084. Дои:10.1210 / jc.2003-031907. PMID 15126524. Получено 2007-01-11.
- ^ Роберт Фредерих, доктор медицины; и другие. (Май 2010 г.). «Систематическая оценка сердечно-сосудистых исходов в программе разработки лекарств саксаглиптина для лечения диабета 2 типа». Последипломная медицина. 122 (3): 16–27. Дои:10.3810 / PGM.2010.05.2138. PMID 20463410.
- ^ Telegram (2 августа 2009 г.). «FDA одобрило лекарство от диабета от двух производителей». Worcester Telegram & Gazette Corp. Получено 2009-08-02.
- ^ Публикация EMA | www.ema.europa.eu/docs/en_GB/document.../WC500044316.pdf
- ^ «Бристол-Майерс Сквибб и Оцука Фармасьютикал Ко., Лтд. Объявляют об эксклюзивном лицензионном соглашении на саксаглиптин, соединение для лечения диабета, в Японии» (Пресс-релиз). Бристол-Майерс Сквибб. 27 декабря 2006 г.. Получено 2006-12-27.
- ^ «AstraZeneca объединяет усилия с Bristol-Myers над лекарствами от диабета». Delaware News-Journal. Ассошиэйтед Пресс. 11 января 2007. Архивировано с оригинал 30 сентября 2007 г.. Получено 2007-01-11.
внешние ссылки
- «Саксаглиптин». Портал информации о наркотиках. Национальная медицинская библиотека США.
- Бантинг и лучший диабетический центр в UT dpp4

