Эстераза ювенильного гормона - Juvenile-hormone esterase
| эстераза ювенильного гормона | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 3.1.1.59 | ||||||||
| Количество CAS | 50812-15-2 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
В энзимология, эстераза ювенильного гормона (JH эстераза) является фермент который катализирует то гидролиз из ювенильный гормон. Например, ювенильный гормон II (обнаруженный в Чешуекрылые ):
- метил (2E, 6E) - (10R, 11S) -10,11-эпокси-3,7,11-триметилтридека-2,6-диеноат + H2О (2E, 6E) - (10R, 11S) -10,11-эпокси-3,7,11-триметилтридека-2,6-диеновая кислота + метанол.
Номенклатура и функции
Этот фермент принадлежит к семейству гидролазы, особенно те, которые действуют на карбоновые сложный эфир облигации. В систематическое название этого класса ферментов - метил- (2E,6E)-(10р,11S) -10,11-эпокси-3,7,11-триметилтридека-2,6-диеноатацилгидролаза. Другие широко используемые названия включают JH эстеразу, эстеразу ювенильного гормона и карбоксиэстеразу ювенильного гормона.
Ювенильный гормон (JH) контролирует насекомых метаморфоза.[1] Высокие титры JH поддерживают личиночное состояние, в то время как снижение титра JH инициирует последовательность окукливания. [2] а также изменение приверженности ткани от синтеза тканей личинки к тканям куколки на стадии куколки.[3] Падение титра JH в начале последнего личиночного возраста у Lepidoptera, по-видимому, связано с комбинацией повышенного метаболизма. [4] и снижение синтеза.[5] в Чешуекрылые, JH первоначально метаболизируется путем гидролиза сложного эфира;[6] эстеразы, способные гидролизовать JH, обнаруживаются в гемолимфа временами в течение последнего личиночного возраста, что, по-видимому, совпадает с зарегистрированными падениями титра JH.[7] JHE также являются селективными в отношении метилового эфира 2E природных JH.[8] Эти исследования предполагают, что JHE могут быть важны в регуляции титра JH и, следовательно, участвовать в инициации и приверженности стадии куколки. JHE, похоже, производятся толстое тело [9] и это производство может быть стимулировано экзогенным JH в Гиалофора куколки, стадия, лишенная активности JHE.[10] Стимуляция активности JHE JH также недавно была отмечена у взрослых Leptinotarsa decemlineata [11] и куколки Galleria mellonella.[12] Однако на сегодняшний день нет опубликованных исследований, изучающих этот феномен в течение последнего личиночного возраста, когда эти ферменты считаются наиболее важными. Таким образом, эта лаборатория провела исследование гемолимфа Регуляция JHE в течение последнего личиночного возраста петлителя капусты, Trichoplusia ni.
Индукция JH эстеразы
Ювенильный гормон эстераза индуцируется факторами, которые естественным образом возникают в голове насекомых.[13] Кроме того, это вызвано обработкой насекомых любым естественным ювенильный гормон, причем JH I является наиболее сильным индуктором.[14] Синтетические агонисты JH обладают такой же активностью, хотя и с меньшей эффективностью, чем JH I.[15] В другом исследовании было показано, что факторы, присутствующие в голове насекомого, являются мощными индукторами активности JH.[16] Голодание личинок чешуекрылых также вызывает появление JH эстеразы.[17]
Ингибиторы JH эстеразы
Обнаружен ряд соединений, которые являются мощными ингибиторами JH эстеразы. Многие из них представляют собой инсектициды, которые подразделяются на две основные структурные группы: фосфоамидотиолаты и S-фенилфосфаты; карбамат инсектициды также были протестированы.[18] Безусловно, самым сильным ингибитором был этокситиофенилфосфамидотиолат с IC50 <1 нМ. Особый интерес в этом исследовании представляет то, что этил и изопропил аналоги природных JH НЕ расщеплялись эстеразой, показывая, что она метил специфический эфир. JH I и JH III были протестированы при номинальной концентрации 5 мкМ. Позже было показано, что трифторметилкетон (3-октилтио-1,1,1-трифтор-2-пропанон) является сильнодействующим, высокоаффинным, медленным и прочным ингибитором связывания JH-эстеразы Trichoplusia ni, того же лепидоптерана, который использовался. в другом исследовании в этом разделе.[19] В этом исследовании сообщается об очень сложном кинетическом анализе ингибирования этого соединения (аббревиатура OTFP), JH I разлагается ферментом легче, чем JH III, при этом значение Km примерно вдвое превышает значение JH III.
Колебания эстеразы JH во времени и в зависимости от развития насекомых
JH эстераза и JH эпоксидгидролаза имеют решающее значение в прекращении действия JH. Роль белков, связывающих ювенильные гормоны, также важна, поскольку они позволяют ювенильный гормон защита от гидролитических ферментов.[20] Это создает очень сложный сценарий, который трудно исследовать, а также трудно различать разные виды. Были проведены очень подробные исследования JH, JH кислоты, экдизон, и титры JH были определены в точно рассчитанных по времени личинках Manduca sexta в зависимости от развития во время пятого личиночного стадиона. У этих личинок основными JH являются JH I и JH II с низкими уровнями JH 0 и JH III. В конце четвертого стадиона наблюдается большой пик JH I и II, сопровождаемый более низкими уровнями их кислотных метаболитов. Затем широкий пик JH-эстеразы начинается с 1,5-го по 4-й день. Затем титры экдистероидов немного повышаются на 3,5-й день, затем массивный пик экдистероидов, начиная с 5-го дня, сохраняется на несколько более низких уровнях до 5-го дня. пик JH I и JH II, начиная с 4-го дня и заканчивая на 6-й день. Титры кислоты JH I почти такие же, как титр JH I, за исключением 7-го дня, когда это острый пик только кислоты JH I. Титры экдистероидов уменьшаются.[21] Очень похожий график пиков JH эстеразы и экдизон наблюдается в Galleria mellonella.[22] Эти данные согласуются с классической моделью чешуекрылых, где JH высока при каждой линьке личинки, но должен расти вместе с экдизон перед окукливанием, чтобы инициировать линьку куколки. Они также согласуются с моделью, предложенной другими, о том, что corra allata поддерживается in vitro в день 0. М. sexta личинка секретирует высокие уровни JH, но на 4-й день происходит переход к производству только кислоты JH, которая затем метилируется имагинальными дисками с образованием пика JH.[23] Однако секреция относительных количеств JH, продуцируемых СА Manduca sexta было обнаружено, что титры значительно отличаются от титров in vivo.[24] Исследование титров JH в Trichoplusia ni привели к очень похожим выводам в отношении временных интервалов импульсов ЮГ и в отношении секреции эдизона. Однако основной JH у этого вида - JH II. Было обнаружено, что инъекция ингибитора эстеразы, EPPAT, увеличивает ювенильный гормон Было обнаружено, что голодание увеличивает титры ювенильных гормонов. Кроме того, паразитирование личинок с Chelonus sp. (Hymenoptera) снижают титры JH II, но вызывают повышение титров JH III, очевидно, вызванное паразитом.[25]
Белковая структура JH эстеразы
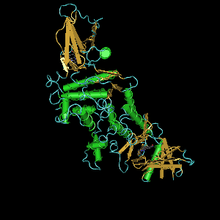
Кристаллическая структура эстеразы табачного рогатого червя Manduca sexta был решен в комплексе с ингибитором аналога переходного состояния 3-октилтио-1,1,1-трифторпропан-2-он (OTFP), ковалентно связанный с активным центром. Эта кристаллическая структура содержит длинный гидрофобный связывающий карман с недоступной для растворителя каталитической триадой, расположенной на конце. Структура объясняет многие взаимодействия, наблюдаемые между JHE и его субстратами и ингибиторами, такие как предпочтение метил эфиры vs. этил или же изопропил сложные эфиры и длинные гидрофобные скелеты.[26] Фермент чрезвычайно эффективен: кот / км составляет не менее 3 x 107 М-1 с-1. Первичная последовательность состоит из 583 аминокислот и 22 аминокислот белка. Расчетное значение Mr активной формы составляет 62,1 кДа.
Письменные ссылки
Абдель-Аал, Ю.А.И., Роу, Р., Хаммок, Б.Д., 1984. Кинетические свойства ингибирования эстеразы ювенильного гормона двумя трифторметилкетонами и O-этил, S-фенилфосфорамидотиоатом. Вредитель. Biochem. Physiol. 21, 232-241.
Baker, F.C., Tsai, L.W., Reuter, C.C., Schooley, D.A., 1987. Колебания in vivo титра JH, JH кислоты и экдистероидов, а также активности JH эстеразы во время развития пятого стадиона Manduca sexta. Insect Biochem. 17, 989-996.
Браун, Р.П., Вятт, Г.Р., 1995. Рост мужской дополнительной железы у взрослых саранчовых: роль ювенильного гормона, эстеразы JH и связывающих белков JH. Arch.Insect Biochem.Physiol. 30, 383-400.
Де Корт, C.A.D., Грейнджер, Н.А., 1996. Регулирование титров JH: важность деградационных ферментов и связывающих белков. Arch. Insect Biochem. Physiol. 33, 1-26.
Гилберт Л.И., Гудман В., Болленбахер У.Э., 1977. Биохимия регуляторных липидов и стеролов у насекомых. // Goodwin T.W. (Ред.), Биохимия липидов II. Международный обзор биохимии. Издательство Юниверсити Парк, Балтимор, стр. I-50.
Hammock, B., Nowock, J., Goodman, W., Stamoudis, V., Gilbert, LI, 1975. Влияние гемолимфо-связывающего белка на стабильность и распределение ювенильных гормонов в жировом теле Manduca-Sexta и воображаемых дисках Invitro . Молекулярная и клеточная эндокринология 3, 167-184.
Hammock, B.D., Quistad, G.B., 1976. Деградационный метаболизм ювеноидов насекомыми, в: Gilbert, L.I. (Ред.), Ювенильные гормоны. Plenum Press, Нью-Йорк, стр. 374–393.
Hammock, B.D., Sparks, T.C., Mumby, S.M., 1977. Избирательное ингибирование эстераз JH из гемолимфы тараканов. Вредитель. Biochem. Physiol. 7, 517-530.
Hwanghsu, K., Reddy, G., Kumaran, A.K., Bollenbacher, W.E., Gilbert, L.I., 1979. Корреляция между активностью эстеразы ювенильного гормона, титром экдизона и клеточным репрограммированием в Galleria-Mellonella. J. Insect Physiol. 25, 105-111.
Джонс, Г., Ханзлик, Т., Гамак, Б.Д., Скули, Д.А., Миллер, К.А., Цай, Л.В., Бейкер, Ф.К., 1990. Титр ювенильного гормона во время предпоследнего и конечного стадий развития личинок Trichoplusia ni. J. Insect Physiol. 36, 77-83.
Джонс, Г., Уинг, К.Д., Джонс, Д., Хаммок, Б.Д., 1980. Источник и действие факторов головы, регулирующих эстеразу ювенильного гормона у личинок петрушки капусты, Trichoplusia ni. J. Insect Physiol. 27, 85-91.
Kramer, S.J., 1978. Регулирование активности JH-специфичных эстераз у колорадского жука, Leptinotarsa decemlineata. J. Insect Physiol. 24, 743-747.
Nijhout, H., Williams, C., 1974. Контроль линьки и метаморфоза у табачного рогатого червя, Manduca Sexta (L.): Прекращение секреции ювенильного гормона как триггер для окукливания J. Exp. Биол. 61, 493-450.
Nijhout, H.F., 1975. Динамика действия ювенильного гормона у личинок рогового червя табака. Биологический бюллетень Морской биологической лаборатории, Вудс-Хоул, 149, 568-579.
Новок, Дж., ГИЛБЕРТ, Л., 1976a. Анализ in vitro факторов, регулирующих титр ювенильного гормона насекомых, в: Kurstack, E., Maramorosch, K. (Eds.), Invertebrate Tissue Culture. Academic Press, Нью-Йорк, стр. 203–212.
Новок Дж., Гилберт Л. И., 1976b. Анализ in vitro факторов, регулирующих титр ювенильного гормона насекомых, в: K., K.E.a.M. (Ред.), Культура тканей беспозвоночных. Academic Press, Нью-Йорк, стр. 203–212.
Plapp, F.W., Jr., Cariño, F.A., Wei, V.K., 1998. Белок, связывающий ювенильный гормон домашней мухи, и его возможная связь с устойчивостью к инсектицидам. Arch. Insect Biochem. Physiol. 37, 64-72.
Прествич, Г.Д., Войтасек, Х., Ленц, А.Дж., Рабинович, Дж. М., 1996. Биохимия белков, которые связывают и метаболизируют ювенильные гормоны. Arch. Insect Biochem. Physiol. 32, 407-419.
Редди, Г., Хвансу, К., Кумаран, А.К., 1979. Факторы, влияющие на активность ювенильной гормон-эстеразы у восковой моли, Galleria-Mellonella. J. Insect Physiol. 25, 65-71.
Риддифорд, Л.М., 1976. Гормональный контроль приверженности эпидермальных клеток насекомых in vitro. Nature 259, 115-117.
Санбург, Л.Л., Крамер, К.Дж., Кезды, Ф.Дж., Закон, Дж. Х., 1975a. Ювенильные гормоноспецифические эстеразы в гемолимфе табачного рогатого червя, Manduca sexta. J. Insect Physiol. 21, 873-887.
Санбург, Л.Л., Крамер, К.Дж., Кезды, Ф.Дж., Ло, Дж. Х., Оберландер, Х., 1975b. Роль эстераз ювенильных гормонов и белков-переносчиков в развитии насекомых. Nature 253, 266-267.
Слэйд М., Зибитт К.Х., 1972. Метаболизм ювенильного гормона Cecropia у насекомых и млекопитающих, в: Менн, Дж. Дж., Бероза, М. (ред.), Ювенильные гормоны насекомых: химия и действие. Academic Press, Нью-Йорк, стр. 155–176.
Sparagana, S.P., Bhaskaran, G., Barrera, P., 1985. Активность кислотной метилтрансферазы ювенильного гормона в имагинальных дисках Manduca sexta prevupae. Arch. Insect Biochem. Physiol. 2, 191-202.
Sparagana, S.P., Bhaskaran, G., Dahm, K.H., Riddle, V., 1984. Продукция ювенильного гормона, эстераза ювенильного гормона и кислотная метилтрансфераза ювенильного гормона в телах allata Manduca sexta. J. Exp. Zool. 230, 309-313.
Спаркс, Т.К., Гаммок, Б.Д., 1979. Индукция и регуляция эстераз ювенильных гормонов в течение последнего личиночного возраста петлителя капусты, Trichoplusia ni. J. Insect Physiol. 25, 551-560.
Спаркс, Т.К., Хаммок, Б.Д., Риддифорд, Л.М., 1983. Гемолифа эстераза ювенильного гормона Manduca sexta (L.) - ингибирование и регулирование. Insect Biochem. 13, 529-541.
Спаркс, T.C., Wing, K.D., Hammock, B.D., 1979. Влияние гормонально-гормонального имитатора ETB на индукцию эстеразы ювенильного гормона насекомых в Trichoplusia ni. Life Sci. 25, 445-450.
Винс, Р.К., Гилберт, Л.И., 1977. Активность ювенильной гормон эстеразы у личинок последнего возраста и фаратных куколок Manduca sexta в точно рассчитанное время. Insect Biochem. 7, 115-120.
Weirich, G., Wren, J., 1973. Субстратная специфичность эстеразы ювенильного гормона из гемолимфы Manduca sexta. Life Sci. 13, 213-226.
Weirich, G.F., Wren, J., 1976. Эстераза ювенильного гормона в развитии насекомых: сравнительное исследование. Физиологическая зоология 49, 341-350.
Уитмор Д., Гилберт Л.И., Иттичер.Пи, 1974. Происхождение гемолимфы карбоксилэстераз, индуцированное ювенильным гормоном насекомых. Молекулярная и клеточная эндокринология 1, 37-54.
Вогулис, М., Уилок, К.Э., Камита, С.Г., Хинтон, А.К., Уетстон, П.А., Хамак, Б.Д., Уилсон, Д.К., 2006. Структурные исследования мощного ингибитора созревания насекомых, связанного с ювенильной гормональной эстеразой Manduca sexta (, ). Биохимия 45, 4045-4057.
дальнейшее чтение
- Фушер А.Л., Макинтош А., Дус Дж., Вастлинг Дж., Тейт А., Тернер С.М. (2006). «Протеомный анализ лекарственной устойчивости к мышьяку у Trypanosoma brucei». Протеомика. 6 (9): 2726–32. Дои:10.1002 / pmic.200500419. PMID 16526094.
- Мицуи Т., Риддифорд Л.М., Беллами Дж. (1979). «Метаболизм ювенильного гормона эпидермисом табачного рогатого червя (Manduca sexta)». Биохимия насекомых. 9 (6): 637–643. Дои:10.1016/0020-1790(79)90103-3.
Рекомендации
- ^ Гилберт и др., 1977
- ^ Ниджхаут и Уильямс, 1974 г.
- ^ Риддифорд, 1976
- ^ Новок и ГИЛБЕРТ, 1976а; Sanburg et al., 1975a; Санбург и др., 1975b
- ^ Ниджхаут, 1975
- ^ Гамак и Кистад, 1976; Слэйд и Зибитт, 1972 г.
- ^ Винс и Гилберт, 1977: Искры, 1979, № 1170; Вейрих и Рен, 1973
- ^ Hammock et al., 1977; Вейрих и Рен, 1973; Вейрих и Рен, 1976 г.
- ^ Hammock et al., 1975; Новок и Гилберт, 1976b; Whitmore et al., 1974
- ^ Whitmore, 1972 # 1160; Whitmore et al., 1974
- ^ Крамер, 1978
- ^ Редди и др., 1979 г.
- ^ Джонс и др., 1980
- ^ Искры и гамак, 1979
- ^ Спаркс и др., 1979
- ^ Джонс и др., 1980
- ^ Спаркс и др., 1983 г.
- ^ Hammock et al., 1977
- ^ Абдель-Аал и др., 1984
- ^ Браун и Вятт, 1995; Де Корт и Грейнджер, 1996; Plapp et al., 1998; Прествич и др., 1996 г.
- ^ Бейкер и др., 1987 г.
- ^ Hwanghsu et al., 1979
- ^ Sparagana et al., 1985; Спарагана и др., 1984
- ^ Бейкер и др., 1987 г.
- ^ Джонс и др., 1990
- ^ Wogulis et al., 2006

