Рибонуклеаза Т - Ribonuclease T
| Рибонуклеаза Т | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Димер рибонуклеазы Т в комплексе с ДНК (оранжевый) из PDB ID 3NH1.[1] | |||||||||
| Идентификаторы | |||||||||
| Символ | rnt | ||||||||
| Pfam | PF00929 | ||||||||
| ИнтерПро | IPR013520 | ||||||||
| УМНАЯ | SM00479 | ||||||||
| |||||||||
Рибонуклеаза Т (РНКаза Т, экзонуклеаза Т, exo T) это рибонуклеаза фермент участвует в созревании переносить РНК и рибосомная РНК в бактерии,[2] а также в Ремонт ДНК пути.[3] Он является членом DnaQ семья экзонуклеазы и непроцессивно действует на 3' конец чего-либо одноцепочечный нуклеиновые кислоты. РНКаза Т способна расщеплять как ДНК и РНК, с крайней последовательность специфичность, дискриминирующая цитозин в 3 'конце субстрат.[1][2]
Устройство и механизм
РНКаза Т катализирует удаление нуклеотидов с 3'-конца как РНК, так и ДНК. Он ингибируется как двухцепочечной ДНК, так и РНК, а также цитозин остатки на 3'-конце РНК. Два цитозина на 3'-конце РНК, по-видимому, полностью устраняют активность РНКазы T.[3] Этот эффект цитозина, однако, наблюдается в меньшей степени с оцДНК. Это отсутствие специфичности последовательности в оцДНК в сочетании с ее способностью воздействовать на оцДНК вблизи дуплексной области привело к ее использованию для создания тупых концов для клонирования ДНК.[4] Структурно РНКаза Т существует как антипараллельный димер.[5][6] и для функционирования требуется двухвалентный катион.[7]
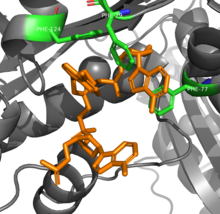
РНКаза Т способна достичь специфичности своей последовательности при переваривании РНК за счет нескольких ароматный остатки, расположенные между азотистыми основаниями. В π -π взаимодействия между четырьмя фенилаланин остатки и два нуклеотида на 3'-конце различаются в зависимости от идентификации нуклеотидов, что изменяет конформацию и, следовательно, активность фермента.[8] Дополнительный глютаминовая кислота Остаток превращается в водородную связь с цитозином не другими основаниями, что дополнительно увеличивает специфичность.[9]
Функция
РНКаза Т, входящая в более крупное семейство экзорибонуклеаз DEDD, играет ключевую роль в созревании тРНК.[10] а также созревание 5S[11] и 23S[12] рРНК домены. В частности, РНКаза Т расщепляет 3 ' AMP остаток из 3 'последовательностей CCA на конце тРНК, что объясняет специфичность последовательности РНКазы T для остановки на 3' последовательности CC.[13] Кроме того, РНКаза Т может играть роль в репарации ДНК, расщепляя 3'-конец выступающей ДНК.[3]
Пока Кишечная палочка могут выжить без РНКазы Т, ее отсутствие приводит к замедлению жизненных циклов и ослаблению реакции на голодание.[14] Кроме того, присутствие РНКазы Т в E. coli связано с повышенной устойчивостью к УФ повреждать.[15] Было высказано предположение, что, хотя другие рибонкуазы могут выполнять функцию РНКазы Т, тот факт, что РНКаза Т более эффективна при расщеплении ДНК и РНК вблизи двухцепочечных областей, означает, что альтернативы менее эффективны.[16] Несмотря на очевидную полезность РНКазы T, фермент обнаружен только в гаммапротеобактерии.[17]
В E. coli РНКаза Т кодируется геном rnt, и предполагается, что она отошла от субъединиц корректирующего считывания полимераза III во время появления гаммапротеобактерий.[16][17]
Рекомендации
- ^ а б Сяо Й., Ду Й, Чен Ю. П., Ван Ю. Т., Юань Х.С. (сентябрь 2012 г.). «Как экзонуклеаза решает, где остановиться в обрезке нуклеиновых кислот: кристаллические структуры комплексов Т-продукт РНКазы». Исследования нуклеиновых кислот. 40 (16): 8144–54. Дои:10.1093 / нар / гкс548. ЧВК 3439924. PMID 22718982.
- ^ а б Цзо Й, член парламента Deutscher (август 2002 г.). «Физиологическая роль РНКазы Т можно объяснить ее необычной субстратной специфичностью». Журнал биологической химии. 277 (33): 29654–61. Дои:10.1074 / jbc.M204252200. PMID 12050169.
- ^ а б c Сяо Й., Фанг WH, Ли CC, Чен Ю.П., Юань Х.С. (март 2014 г.). «Структурное понимание репарации ДНК с помощью РНКазы Т - экзонуклеазы, обрабатывающей 3'-конец структурированной ДНК в путях репарации». PLOS Биология. 12 (3): e1001803. Дои:10.1371 / journal.pbio.1001803. ЧВК 3942315. PMID 24594808.
- ^ Цзо Й, член парламента Deutscher (октябрь 1999 г.). «Активность ДНКазы РНКазы Т и ее применение для клонирования ДНК». Исследования нуклеиновых кислот. 27 (20): 4077–82. Дои:10.1093 / nar / 27.20.4077. ЧВК 148676. PMID 10497273.
- ^ Ли З, Чжань Л., Deutscher MP (январь 1996 г.). «РНКаза T Escherichia coli функционирует in vivo как димер, зависимый от цистеина 168». Журнал биологической химии. 271 (2): 1133–7. Дои:10.1074 / jbc.271.2.1133. PMID 8557641.
- ^ Zuo Y, Zheng H, Wang Y, Chruszcz M, Cymborowski M, Skarina T. и др. (Апрель 2007 г.). «Кристаллическая структура РНКазы Т, экзорибонуклеазы, участвующей в созревании тРНК и ее обороте». Структура. 15 (4): 417–28. Дои:10.1016 / j.str.2007.02.004. ЧВК 1907377. PMID 17437714.
- ^ Deutscher MP, Marlor CW (июнь 1985 г.). «Очистка и характеристика РНКазы Т Escherichia coli». Журнал биологической химии. 260 (11): 7067–71. PMID 3888994.
- ^ Duh Y, Hsiao YY, Li CL, Huang JC, Yuan HS (декабрь 2015 г.). «Ароматические остатки в стеке РНКазы Т с азотистыми основаниями для направления специфичного для последовательности распознавания и расщепления нуклеиновых кислот». Белковая наука. 24 (12): 1934–41. Дои:10.1002 / pro.2800. ЧВК 4815224. PMID 26362012.
- ^ Сяо Й., Ян СС, Линь С.Л., Линь Дж.Л., Ду Й., Юань Х.С. (апрель 2011 г.). «Структурная основа обрезки РНК РНКазой Т при созревании стабильного 3'-конца РНК». Природа Химическая Биология. 7 (4): 236–43. Дои:10.1038 / nchembio.524. PMID 21317904.
- ^ Ли Зи, член парламента Deutscher (август 1996 г.). «Пути созревания для предшественников тРНК E. coli: случайный мультиферментный процесс in vivo». Клетка. 86 (3): 503–12. Дои:10.1016 / s0092-8674 (00) 80123-3. PMID 8756732.
- ^ Ли Зи, член парламента Deutscher (июль 1995 г.). «Фермент, обрабатывающий тРНК, РНКаза Т, необходим для созревания 5S РНК». Труды Национальной академии наук Соединенных Штатов Америки. 92 (15): 6883–6. Bibcode:1995PNAS ... 92.6883L. Дои:10.1073 / пнас.92.15.6883. ЧВК 41434. PMID 7542780.
- ^ Ли З, Пандит С., Deutscher MP (январь 1999 г.). «Созревание 23S рибосомной РНК требует экзорибонуклеазы РНКазы Т». РНК. 5 (1): 139–46. Дои:10,1017 / с 1355838299981669. ЧВК 1369746. PMID 9917073.
- ^ Deutscher MP, Marlor CW, Zaniewski R (июль 1984). «Рибонуклеаза Т: новая экзорибонуклеаза, возможно, вовлеченная в конечный оборот тРНК». Труды Национальной академии наук Соединенных Штатов Америки. 81 (14): 4290–3. Bibcode:1984PNAS ... 81.4290D. Дои:10.1073 / пнас.81.14.4290. ЧВК 345573. PMID 6379642.
- ^ Келли К.О., Deutscher MP (октябрь 1992 г.). «Присутствия только одной из пяти экзорибонуклеаз достаточно для поддержки роста Escherichia coli». Журнал бактериологии. 174 (20): 6682–4. Дои:10.1128 / jb.174.20.6682-6684.1992. ЧВК 207653. PMID 1400219.
- ^ Вишванатан М., Ланджуин А., Ловетт С.Т. (март 1999 г.). «Идентификация РНКазы Т как высококопийного супрессора чувствительности к УФ-излучению, связанной с дефицитом однонитевой экзонуклеазы ДНК в Escherichia coli». Генетика. 151 (3): 929–34. ЧВК 1460521. PMID 10049912.
- ^ а б Bechhofer DH, Deutscher MP (июнь 2019 г.). «Бактериальные рибонуклеазы и их роль в метаболизме РНК». Критические обзоры в биохимии и молекулярной биологии. 54 (3): 242–300. Дои:10.1080/10409238.2019.1651816. ЧВК 6776250. PMID 31464530.
- ^ а б Цзо Й, член парламента Deutscher (март 2001 г.). «Суперсемейства экзорибонуклеаз: структурный анализ и филогенетическое распределение». Исследования нуклеиновых кислот. 29 (5): 1017–26. Дои:10.1093 / nar / 29.5.1017. ЧВК 56904. PMID 11222749.
