Цинк-зависимая фосфолипаза C - Zinc-dependent phospholipase C
| Цинк-зависимая фосфолипаза C | |||||||||
|---|---|---|---|---|---|---|---|---|---|
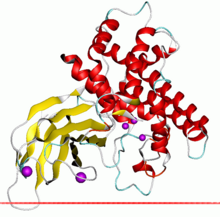 Альфа-токсин из Clostridium показаны цинк-зависимый домен фосфолипазы красным цветом и домен PLAT желтым | |||||||||
| Идентификаторы | |||||||||
| Символ | Zn_dep_PLPC | ||||||||
| Pfam | PF00882 | ||||||||
| ИнтерПро | IPR001531 | ||||||||
| PROSITE | PDOC00357 | ||||||||
| SCOP2 | 1ah7 / Объем / СУПФАМ | ||||||||
| OPM суперсемейство | 81 | ||||||||
| Белок OPM | 1олп | ||||||||
| CDD | cd11009 | ||||||||
| |||||||||
В молекулярная биология, цинк-зависимые фосфолипазы C это семейство бактериальных фосфолипазы С ферменты, некоторые из которых также известны как альфа-токсины.
Bacillus cereus содержит мономерную фосфолипазу C EC 3.1.4.3 (PLC) из 245 аминокислотных остатков. Хотя ПЛК предпочитает действовать фосфатидилхолин, он также проявляет слабую каталитическую активность с сфингомиелин и фосфатидилинозитол.[1] Исследования последовательности показали, что белок похож как на альфа-токсин из Clostridium perfringens и Clostridium bifermentans, фосфолипаза С, участвующая в гемолизе и разрыве клеток,[2] и чтобы лецитиназа от Listeria monocytogenes, который способствует распространению от клетки к клетке, разрушая 2-мембранные вакуоли, которые окружают бактерию во время переноса.[3]
Каждый из этих белков является цинк-зависимым ферментом, связывающим 3 иона цинка на молекулу.[4] Ферменты катализируют превращение фосфатидилхолина и воды в 1,2-диацилглицерин и фосфат холина.[1][2][4]
В Bacillus cereus, известно, что в связывании ионов цинка участвуют девять остатков: 5 His, 2 Asp, 1 Glu и 1 Trp. Все эти остатки законсервированы в Clostridium альфа-токсин.
Некоторые примеры этого фермента содержат удлинение С-концевой последовательности, которое содержит PLAT домен который, как полагают, участвует в локализации мембраны.[5][6]
использованная литература
- ^ а б Накамура С., Ямада А., Цукагоши Н., Удака С., Сасаки Т., Макино С., Литтл К., Томита М., Икэдзава Х (1988). «Нуклеотидная последовательность и экспрессия в кишечная палочка гена, кодирующего сфингомиелиназу Bacillus cereus". Евро. J. Biochem. 175 (2): 213–220. Дои:10.1111 / j.1432-1033.1988.tb14186.x. PMID 2841128.
- ^ а б Titball RW, Рубидж Т., Хантер С.Е., Мартин К.Л., Моррис BC, Шаттлворт А.Д., Андерсон Д.В., Келли, округ Колумбия (1989). «Молекулярное клонирование и нуклеотидная последовательность альфа-токсина (фосфолипаза С) Clostridium perfringens". Заразить. Иммунная. 57 (2): 367–376. Дои:10.1128 / IAI.57.2.367-376.1989. ЧВК 313106. PMID 2536355.
- ^ Кокс С., Драмси С., Охайон Х, Жоффрой С., Менгауд Дж., Коссарт П., Васкес-Боланд Дж. А. (1992). «Нуклеотидная последовательность оперона лецитиназы Listeria monocytogenes и возможная роль лецитиназы в распространении от клетки к клетке ». Заразить. Иммунная. 60 (1): 219–230. Дои:10.1128 / IAI.60.1.219-230.1992. ЧВК 257526. PMID 1309513.
- ^ а б Титболл RW, Рубидж Т. (1990). "Роль остатков гистидина в альфа-токсине Clostridium perfringens". FEMS Microbiol. Латыш. 56 (3): 261–265. Дои:10.1111 / j.1574-6968.1988.tb03188.x. PMID 2111259.
- ^ Бейтман А., Сэндфорд Р. (1999). «Домен PLAT: новый элемент в головоломке PKD1». Curr. Биол. 9 (16): R588–90. Дои:10.1016 / S0960-9822 (99) 80380-7. PMID 10469604. S2CID 15018010.
- ^ Понтинг С.П., Хофманн К., Борк П. (август 1999 г.). «Латрофилин / CL-1-подобный домен GPS в полицистине-1». Curr. Биол. 9 (16): R585–8. Дои:10.1016 / S0960-9822 (99) 80379-0. PMID 10469603. S2CID 17252179.
| Эта мембранный белок –Связанная статья является заглушка. Вы можете помочь Википедии расширяя это. |
