Гипертрофическая кардиомиопатия - Hypertrophic cardiomyopathy
| Гипертрофическая кардиомиопатия | |
|---|---|
| Другие имена | Асимметричная гипертрофия перегородки; идиопатический гипертрофический субаортальный стеноз;[1] гипертрофическая обструктивная кардиомиопатия (HOCM) |
 | |
| Специальность | Кардиология |
| Симптомы | Чувство усталости, отек ноги, одышка, грудная боль, обморок[2] |
| Осложнения | Сердечная недостаточность, аритмия, внезапная сердечная смерть[3][4] |
| Причины | Генетика, Болезнь Фабри, Атаксия Фридрейха, некоторые лекарства[5][6] |
| Диагностический метод | ЭКГ, эхокардиограмма, Стресс-тестирование, генетическое тестирование[7] |
| Дифференциальная диагностика | Гипертоническая болезнь сердца, стеноз аорты, сердце спортсмена[5] |
| Уход | Лекарства, имплантируемый кардиодефибриллятор, хирургия[7] |
| Медикамент | Бета-блокаторы, мочегонные средства, дизопирамид[7] |
| Прогноз | Риск смерти менее 1% в год (при лечении)[8] |
| Частота | 1 из 500 человек[9] |
Гипертрофическая кардиомиопатия (HCM) - состояние, при котором сердце становится утолщенный без очевидной причины.[9] Чаще всего поражаются межжелудочковая перегородка и желудочки.[10] Это приводит к тому, что сердце не может перекачивать кровь. кровь эффективно, а также может вызвать проблемы с электропроводностью.[3]
Люди с HCM могут иметь ряд симптомов. У людей может быть бессимптомное течение или может быть утомляемость. отек ноги, и одышка.[2] Это также может привести к грудная боль или же обморок.[2] Симптомы могут усиливаться, когда человек обезвожен.[10] Осложнения могут включать: сердечная недостаточность, аритмия, и внезапная сердечная смерть.[3][4]
HCM чаще всего унаследованный от родителей человека[6] по аутосомно-доминантному типу.[10] Часто это происходит из-за мутации в определенных гены участвует в создании сердечная мышца белки.[6] Другие наследственные причины гипертрофии левого желудочка могут включать: Болезнь Фабри, Атаксия Фридрейха, и некоторые лекарства, такие как такролимус.[5] Другие причины увеличения сердца - это сердце спортсмена и гипертония (высокое кровяное давление).[10] Для постановки диагноза HCM часто требуется семейный анамнез или родословная, ЭКГ, эхокардиограмма, и Стресс-тестирование.[7] Генетическое тестирование также может быть сделано.[7] ГКМП можно отличить от других наследственных причин кардиомиопатии по аутосомно-доминантному типу, тогда как болезнь Фабри и атаксия Фридрейха наследуются по аутосомно-рецессивному типу.[10]
Лечение может зависеть от симптомов и других факторов риска. Лекарства могут включать использование бета-блокаторы или же дизопирамид.[7] An имплантируемый кардиодефибриллятор может быть рекомендован людям с некоторыми типами нерегулярного сердцебиения.[7] Хирургия в виде септальная миэктомия или же пересадка сердца, может быть сделано для тех, кто не улучшился с помощью других мер.[7] При лечении риск смерти от болезни составляет менее одного процента в год.[8]
HCM поражает примерно одного из 500 человек.[9] Ставки у мужчин и женщин примерно равны.[9] Пострадать могут люди любого возраста.[9] Первое современное описание болезни принадлежит Дональд Тир в 1958 г.[11][12]
Признаки и симптомы
Течение HCM вариабельно. Многие люди протекают бессимптомно или с легкими симптомами, и многие из тех, кто несет гены болезни ГКМП, не имеют клинически выявляемого заболевания.[13] В симптомы ГКМП включают одышку из-за жесткости и снижения кровенаполнения желудочков, боль в груди при физической нагрузке (иногда известную как стенокардия ) из-за снижения притока крови к коронарным артериям, дискомфортное ощущение сердцебиение (сердцебиение ), а также нарушение работы электрической системы, проходящей через аномальную сердечную мышцу, легкомысленность, слабое место, обморок и внезапная сердечная смерть.[14]
Одышка во многом из-за повышенной жесткости левый желудочек (LV), что нарушает наполнение желудочков, но также приводит к повышению давления в левом желудочке и левом предсердии, вызывая обратное давление и интерстициальный застой в легких. Симптомы не связаны напрямую с наличием или серьезностью градиента оттока.[15] Часто симптомы имитируют хроническая сердечная недостаточность (особенно непереносимость активности и одышка), но лечение каждого из них разное. Бета-адреноблокаторы используются в обоих случаях, но лечение диуретиками, являющееся основой лечения ХСН, усугубит симптомы гипертрофической обструктивной кардиомиопатии за счет уменьшения преднагрузки желудочков и, таким образом, увеличения сопротивления оттоку (меньшее количество крови, чтобы отодвинуть утолщенную закупоривающую ткань).[16]
Основные факторы риска внезапной смерти у людей с ГКМП включают предшествующий анамнез: остановка сердца или же мерцание желудочков, спонтанный устойчивый вентрикулярная тахикардия, семейная история преждевременной внезапной смерти, необъяснимая обморок, Толщина LVW более 15–30 мм, аномальное артериальное давление при физической нагрузке и неустойчивая желудочковая тахикардия.[17][18]
Импульс "шип и купол" и "тройная рябь" верхушечный толчок «два других признака, которые можно обнаружить при физическом осмотре.[19]
Генетика
| Ген | Locus | Тип |
|---|---|---|
| MYH7 | 14q12 | CMH1 ( 192600 ) |
| TNNT2 | 1q32 | CMH2 ( 115195 ) |
| TPM1 | 15q22.1 | CMH3 ( 115196 ) |
| MYBPC3 | 11p11.2 | CMH4 ( 115197 ) |
| ? | ? | CMH5 |
| ПРКАГ2 | 7q36 | CMH6 ( 600858 ) |
| TNNI3 | 19q13.4 | CMH7 ( 613690 ) |
| MYL3 | 3p | CMH8 ( 608751 ) |
| TTN | 2q24.3 | CMH9 ( 613765 ) |
| MYL2 | 12q23-q24 | CMH10 ( 608758 ) |
| ACTC1 | 15q14 | CMH11 ( 612098 ) |
| CSRP3 | 11п15.1 | CMH12 ( 612124 ) |
Семейная гипертрофическая кардиомиопатия передается по наследству как аутосомно-доминантный признак и относится к мутациям в одном из ряда гены которые кодируют для саркомер белки.[10]
В настоящее время около 50–60% людей с высоким индексом клинического подозрения на ГКМП будут иметь мутацию, идентифицированную по крайней мере в одном из девяти саркомерных генов. Примерно 40% этих мутаций происходят в β-тяжелая цепь миозина ген на хромосома 14 q11.2-3, и примерно 40% связаны с сердечным миозин-связывающий протеин C ген. Поскольку HCM обычно аутосомно-доминантный В этом случае дети от одного родителя с ГКМП имеют 50% шанс унаследовать мутацию, вызывающую заболевание. Когда бы ни была выявлена такая мутация, можно использовать семейное генетическое тестирование для выявления родственников, подверженных риску заболевания, хотя клиническую тяжесть и возраст начала невозможно предсказать.[20]
У лиц без семейного анамнеза ГКМП наиболее частой причиной заболевания является de novo мутация гена, продуцирующего тяжелую цепь β-миозина.
Полиморфизм вставки / удаления в гене, кодирующем фермент, превращающий ангиотензин (ACE) изменяет клиническую фенотип болезни. Генотип D / D (делеция / делеция) АПФ связан с более выраженной гипертрофией левого желудочка и может быть связан с более высоким риском неблагоприятных исходов.[21][22]
Некоторые мутации могут иметь более опасный потенциал по сравнению с другими (тяжелая цепь β-миозина). Например, тропонин Т Изначально мутации были связаны с 50% смертностью в возрасте до 40 лет. Однако более недавнее и более крупное исследование обнаружило аналогичный риск для других мутаций саркомерного белка.[23] Возраст начала заболевания HCM с MYH7 более ранний и приводит к более тяжелым симптомам.[24] Более того, мутации на тропонин С может изменить Ca+2 чувствительности к развитию силы в сердечной мышце, эти мутации названы в честь аминокислоты, которая была изменена в соответствии с местом, в котором это произошло, например A8V, A31S, C84Y и D145E.[25]
Диагностика
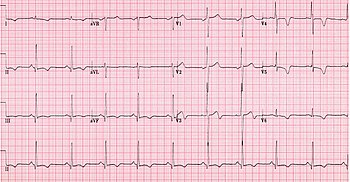
А диагноз гипертрофической кардиомиопатии основывается на ряде особенностей болезненного процесса. Пока есть использование эхокардиография, катетеризация сердца, или же МРТ сердца При диагностике болезни другие важные соображения включают: ЭКГ, генетическое тестирование (хотя в первую очередь не используется для диагностики),[26] а также любой семейный анамнез ГКМП или необъяснимой внезапной смерти у здоровых людей.
Примерно в 60-70% случаев МРТ сердца показывает утолщение более чем на 15 мм нижней части межжелудочковой перегородки. Визуализация, взвешенная по T1, может выявить рубцевание сердечных тканей, в то время как T2-взвешенная визуализация может выявить отек и воспаление сердечной ткани, которые связаны с острыми клиническими признаками боли в груди и эпизодами обморока.[27]
Pulsus bisferiens время от времени могут быть обнаружены при обследовании.[28]
Обструктивный или необструктивный
В зависимости от того, вызывает ли искажение нормальной анатомии сердца препятствие оттоку крови из левого желудочка сердца, HCM можно классифицировать как обструктивный или необструктивный.
- Обструктивный вариант HCM, гипертрофическая обструктивная кардиомиопатия (HOCM), также исторически известен как идиопатический гипертрофический субаортальный стеноз (IHSS) и асимметричная гипертрофия перегородки (ASH).
- Другой, необструктивный вариант ГКМП - апикальная гипертрофическая кардиомиопатия,[29] также называемый синдромом Ямагути или гипертрофией Ямагути, впервые описанный у лиц с Японский спуск.
Катетеризация сердца

АО = нисходящая аорта; LV = левый желудочек; ЭКГ = электрокардиограмма.
После третьего QRS комплекс у желудочка больше времени для наполнения. Поскольку у него больше времени для наполнения, левый желудочек будет иметь больший объем в конце диастола (повысился предварительная нагрузка ). Из-за Закон сердца Франка – Старлинга, сокращение левого желудочка (и давление, создаваемое левым желудочком) будет больше при следующем сокращении (сокращение № 4 на этом рисунке). Из-за динамического характера обструкции оттока при ГКМП обструкция увеличивается. более чем повышение давления в левом желудочке. Это вызывает падение аортального давления по мере роста давления в левом желудочке (на рисунке это заштрихованная желтая область).
На катетеризация сердца, катетеры можно размещать в левом желудочке и восходящей аорта, чтобы измерить перепад давления между этими конструкциями. У нормальных людей во время желудочкового систола давление в восходящей аорте и левом желудочке уравняется, а аортальный клапан открыт. У лиц с стеноз аорты или с HCM с градиентом тракта оттока будет градиент (разница) давления между левым желудочком и аортой, при этом давление в левом желудочке будет выше, чем давление в аорте. Этот градиент представляет собой степень обструкции, которую необходимо преодолеть, чтобы выбросить кровь из левого желудочка.
Признак Брокенбро – Браунвальда – Морроу наблюдается у лиц с ГКМП с градиентом тракта оттока. Этот признак можно использовать для дифференциации ГКМП от стеноза аорты. У лиц со стенозом аорты после преждевременное сокращение желудочков (PVC), следующее сокращение желудочка будет более сильным, и давление, создаваемое в левом желудочке, будет выше. Из-за фиксированной обструкции, которую представляет стенозирующий аортальный клапан, давление в восходящей аорте после ЖХ также будет увеличиваться. Однако у людей с HCM степень обструкции увеличится больше, чем сила сокращения в толчке после PVC. Результатом этого является повышение давления в левом желудочке и повышение давления в восходящей аорте. уменьшается, с увеличением градиента LVOT.
В то время как симптом Брокенбро – Браунвальда – Морроу наиболее ярко проявляется при одновременном использовании внутрисердечных и внутриаортальных катетеров, его можно увидеть при обычном физикальном обследовании как снижение пульсового давления в сокращении после ЖЭ у лиц с ГКМП.
Скрининг
Хотя ГКМП может протекать бессимптомно, у пораженных людей симптомы могут варьироваться от легкой до критической сердечной недостаточности и внезапной сердечной смерти в любой момент от раннего детства до старшинства.[30][31] ГКМП является ведущей причиной внезапной сердечной смерти у молодых спортсменов в США и наиболее распространенным генетическим сердечно-сосудистым заболеванием.[4] Одно исследование показало, что частота внезапной сердечной смерти у молодых конкурентоспособных спортсменов снизилась в регионе Венето в Италии на 89% с момента введения в 1982 году обычного кардиологического скрининга для спортсменов с необычно высокого начального уровня.[32] Однако по состоянию на 2010 год исследования показали, что частота внезапной сердечной смерти среди всех людей с ГКМП снизилась до одного процента или меньше.[33] Людям с положительным результатом скрининга, у которых диагностировано сердечное заболевание, обычно советуют избегать соревнований по легкой атлетике.
HCM можно обнаружить с помощью эхокардиограмма (ECHO) с точностью 80% +,[нужна цитата ] которому может предшествовать скрининг с ЭКГ (ЭКГ) для проверки сердечных аномалий. Магнитно-резонансная томография сердца (CMR), считающийся золотым стандартом для определения физических свойств стенки левого желудочка, может служить альтернативным инструментом скрининга, когда эхокардиограмма дает неубедительные результаты.[34] Например, выявить сегментарную боковую гипертрофию желудочков нельзя только с помощью эхокардиографии. Также гипертрофия левого желудочка может отсутствовать у детей до тринадцати лет. Это подрывает результаты эхокардиограммы детей до подросткового возраста.[30] Однако исследователи изучали бессимптомных носителей мутации, вызывающей HCM, с помощью CMR и смогли идентифицировать крипты в ткани межжелудочковой перегородки у этих людей. Было высказано предположение, что образование этих крипт является признаком беспорядка миоцитов и измененных стенок сосудов, что может позже привести к клинической экспрессии HCM.[34] Возможное объяснение этого состоит в том, что типичный сбор семейного анамнеза сосредотачивается только на том, произошла ли внезапная смерть или нет. Он не учитывает возраст, в котором родственники умерли от сердечной смерти, а также частоту сердечных приступов. Более того, учитывая несколько факторов, которые необходимо учитывать в качестве факторов риска внезапной сердечной смерти, хотя большинство факторов не имеют сильной прогностической ценности по отдельности, существует неопределенность в отношении того, когда применять специальное лечение.[35]
Соединенные Штаты
Есть несколько потенциальных проблем, связанных с рутинным скринингом на HCM в Соединенных Штатах.[36] Во-первых, 15 миллионов спортсменов в США почти в два раза больше, чем в Италии.[36] Во-вторых, эти события редки, менее 100 смертей в США из-за HCM у конкурентоспособных спортсменов в год.[37] или около 1 смерти на 220 000 спортсменов.[38] Наконец, окончательный диагноз поставит генетическое тестирование; однако из-за многочисленных мутаций, вызывающих HCM, этот метод скрининга сложен и не является рентабельным.[30] Следовательно, генетическое тестирование в Соединенных Штатах ограничено людьми, у которых проявляются явные симптомы HCM, и членами их семей. Это гарантирует, что тест не будет потрачен впустую на выявление других причин гипертрофии желудочков (из-за его низкой чувствительности), и что члены семьи человека будут осведомлены о потенциальном риске быть носителями мутантного гена (ов).[39]
Канада
Канадские руководящие принципы и рекомендации по генетическому тестированию для людей с диагнозом HCM следующие:[26]
- Основная цель генетического тестирования - проверка членов семьи.
- Согласно результатам, родственникам из группы риска может быть предложено пройти обширное обследование.
- Генетическое тестирование не предназначено для подтверждения диагноза.
- Если у диагностированного человека нет родственников из группы риска, генетическое тестирование не требуется.
- Генетическое тестирование не предназначено для оценки риска или принятия решений о лечении.
- Доказательства подтверждают только клинические испытания для прогнозирования прогрессирования и риска развития осложнений ГКМП.
Для физических лиц подозреваемый наличия HCM:
- Не рекомендуется генетическое тестирование для определения других причин гипертрофии левого желудочка (например, "сердце спортсмена ", гипертония и кардиальный амилоидоз).
- ГКМП можно отличить от других состояний, вызывающих гипертрофию, с помощью истории болезни и клинических испытаний.
Великобритания
Вскрытие после смерти телеведущего Дэвид Фрост в 2013 году обнаружил, что у него ГКМП, хотя это не способствовало его смерти, и его семья не была проинформирована. Внезапная сердечная смерть его 31-летнего сына в 2015 году побудила семью сотрудничать с Британский фонд сердца собрать средства на лучший скрининг.[40]
Уход
Бессимптомные люди
Значительное количество людей с гипертрофической кардиомиопатией не имеют никаких симптомов и имеют нормальную продолжительность жизни, хотя им следует избегать особо напряженных занятий или соревнований по легкой атлетике. Бессимптомных людей следует обследовать на предмет факторов риска внезапной сердечной смерти. У людей с нарушением оттока в состоянии покоя или индуцируемой обструкцией следует избегать ситуаций, которые могут вызвать обезвоживание или расширение сосудов (например, использование сосудорасширяющих или мочегонных препаратов для повышения кровяного давления). У бессимптомных людей терапия по уменьшению перегородки не рекомендуется.[7]
Лекарства
Основная цель лекарств - облегчить такие симптомы, как боль в груди, одышка и сердцебиение. Бета-блокаторы считаются препаратами первой линии, поскольку они могут замедлять частоту сердечных сокращений и уменьшать вероятность эктопических сокращений. Для людей, которые не переносят бета-адреноблокаторы, недигидропиридин. блокаторы кальциевых каналов Такие как верапамил могут быть использованы, но потенциально вредны для людей с низким артериальным давлением или сильной одышкой в состоянии покоя. Эти лекарства также снижают частоту сердечных сокращений, хотя их следует применять у людей с тяжелой обструкцией оттока, повышенным давлением заклинивания легочной артерии и низким кровяным давлением. Людям с признаками обструкции следует избегать применения блокаторов дигидропиридиновых кальциевых каналов. Для людей, симптомы которых не облегчаются вышеуказанными методами лечения, дизопирамид можно рассмотреть для дальнейшего облегчения симптомов. Диуретики могут быть рассмотрены для людей с признаками перегрузки жидкостью, но с осторожностью применяться у людей с признаками обструкции. Люди, у которых симптомы не исчезают, несмотря на лекарственную терапию, могут рассмотреть возможность более инвазивных методов лечения. Внутривенный фенилэфрин (или другой чистый сосудосуживающий агент) может использоваться в острой стадии низкого кровяного давления у пациентов с обструктивной гипертрофической кардиомиопатией, которые не реагируют на введение жидкости.[7]
Хирургическая миэктомия перегородки
Хирургический септальная миэктомия является операция на открытом сердце делается для облегчения симптомов у людей, у которых симптомы остаются тяжелыми, несмотря на медикаментозное лечение. Успешно проводится с начала 1960-х годов.[17] Хирургическая миэктомия с перегородкой равномерно снижает обструкцию выводного тракта левого желудочка и улучшает симптомы, а в опытных центрах хирургическая летальность составляет менее 1%, а показатель успеха составляет 85%.[31] Он включает срединную стернотомию (общая анестезия, вскрытие грудной клетки и сердечно-легочный обход ) и удаление части межжелудочковой перегородки.[30] Хирургическая миэктомия, направленная только на субаортальную перегородку с целью увеличения размера оттока и уменьшения сил Вентури, может оказаться недостаточной для устранения систолического переднего движения (SAM) передней створки митрального клапана. При этой ограниченной резекции остаточная выпуклость в середине перегородки по-прежнему перенаправляет кровоток назад; SAM сохраняется, потому что поток все еще идет за митральный клапан. Только когда резектируется более глубокая часть выступа перегородки, поток перенаправляется кпереди от митрального клапана, устраняя SAM. Имея это в виду, модификация миэктомии Морроу, называемая расширенной миэктомией, мобилизацией и частичным иссечением папиллярных мышц, стала предпочтительной.[41][42][43][44] У людей с особенно большими избыточными митральными клапанами может быть добавлена складка передней створки для полного разделения митрального клапана и оттока.[44] Осложнения операции миэктомии перегородки включают возможную смерть, аритмию, инфекцию, непрекращающееся кровотечение, перфорацию / дефект перегородки и инсульт.[31]
Спиртовая абляция перегородки
Спиртовая абляция перегородки, представлен Ульрих Зигварт в 1994 г. чрескожный техника, которая включает инъекцию алкоголя в одну или несколько перегородок левая передняя нисходящая артерия. Это катетер методика с результатами, аналогичными хирургической процедуре миэктомии перегородки, но менее инвазивна, поскольку не включает общую анестезию и вскрытие грудной стенки и перикарда (которые выполняются при миэктомии перегородки). В избранной популяции с симптомами, вторичными по отношению к высокому градиенту оттока, абляция спиртовой перегородки может уменьшить симптомы ГКМП. Кроме того, пожилые люди и люди с другими медицинскими проблемами, для которых хирургическая миэктомия представляет собой повышенный процедурный риск, вероятно, выиграют от менее инвазивной процедуры абляции перегородки.[30][45]
При правильном выполнении абляция спиртовой перегородки вызывает контролируемый острое сердечно-сосудистое заболевание, при котором часть межжелудочковой перегородки, которая включает выводящий тракт левого желудочка, подвергается инфаркту и сокращается до рубца. Ведутся споры о том, каким людям лучше всего подходит хирургическая миэктомия, абляция перегородки с использованием спирта или медикаментозное лечение.[46]
Митральный зажим
С 2013 г. митральные зажимы были имплантированы через катетер в качестве новой стратегии коррекции движения митрального клапана у людей с тяжелой обструктивной ГКМП. Устройство скрепляет створки митрального клапана, чтобы улучшить отток крови из сердца. Клипса для митрального клапана еще не доказала долгосрочную надежность миэктомии перегородки или алкогольной аблации перегородки, но специалисты по HCM все чаще предлагают клипсу как менее инвазивный вариант лечения.[47][48]
Имплантируемый кардиостимулятор или дефибриллятор
Использование кардиостимулятор был рекомендован в подгруппе людей, чтобы вызвать асинхронное сокращение левого желудочка. Поскольку кардиостимулятор активирует межжелудочковую перегородку раньше, чем свободная стенка левого желудочка, градиент оттока левого желудочка может уменьшаться. Было показано, что эта форма лечения обеспечивает меньшее облегчение симптомов и меньшее уменьшение градиента выходного тракта левого желудочка по сравнению с хирургической миэктомией.[49] Технологические достижения также привели к разработке двухкамерного кардиостимулятора, который включается только при необходимости (в отличие от обычного кардиостимулятора, который обеспечивает постоянный стимул). Несмотря на то, что двухкамерный кардиостимулятор снижает обструкцию выводного тракта желудочков, экспериментальные испытания выявили лишь несколько человек с улучшенными симптомами.[35] Исследователи подозревают, что эти сообщения об улучшении симптомов связаны с плацебо эффект.[31]
Процедура включает разрез в переднебоковой области ниже ключицы. Затем вставляются два отведения; один в правое предсердие, а другой в верхушку правого желудочка через подключичные вены. На месте они закрепляются и прикрепляются к генератору, который остается внутри фасции, перед грудной мышцей.[31] Осложнения этой процедуры включают инфицирование, неисправность электрического провода и генератора, которые потребуют замены.[31]
Для людей с HCM, которые демонстрируют один или несколько основных факторов риска внезапной сердечной смерти, имплантируемый кардиовертер-дефибриллятор (ICD) или комбинированный кардиостимулятор / ICD all-in-one может быть рекомендован в качестве надлежащей меры предосторожности.[7][17][50][51] В 2014, Европейское общество кардиологов предложил практическую оценку риска для расчета этого риска. [52]
Трансплантация сердца
В случаях, когда все другие формы лечения не поддаются лечению, трансплантация сердца это один из вариантов. Это также единственный доступный метод лечения сердечной недостаточности в терминальной стадии.[35] Однако трансплантация должна быть проведена до появления таких симптомов, как гипертензия легочных сосудов, нарушение функции почек и тромбоэмболия, чтобы она была успешной. Исследования показали, что семилетняя выживаемость у людей с ГКМП после трансплантации составляет 94%.[35]
Прогноз
Систематический обзор, проведенный в 2002 году, пришел к выводу, что: «В целом, HCM дает ежегодный уровень смертности около 1% ... HCM может быть связан с важными симптомами и преждевременной смертью, но чаще с отсутствием или относительно легкой инвалидностью и нормальной продолжительностью жизни».[30]
Дети
Несмотря на то, что гипертрофическая кардиомиопатия (ГКМП) может присутствовать в раннем возрасте и, скорее всего, является врожденной, это одна из наиболее редких сердечных аномалий, встречающихся в детской кардиологии, в основном потому, что симптомы обычно отсутствуют, являются неполными или проявляются позже во взрослом возрасте. . Большая часть текущей информации, относящейся к HCM, получена в результате исследований среди взрослого населения, и значение этих наблюдений для педиатрической популяции часто остается неопределенным.[53] Тем не менее, недавние исследования в области детской кардиологии показали, что на ГКМП приходится 42% детских кардиомиопатий с ежегодной заболеваемостью 0,47 на 100 000 у детей.[54] Кроме того, в бессимптомных случаях внезапная смерть считается одним из самых страшных осложнений, связанных с заболеванием в отдельных педиатрических группах. Следовательно, рекомендуемая практика состоит в том, чтобы обследовать детей пострадавших людей на протяжении всего детства для выявления сердечных аномалий на ранней стадии в надежде предотвратить дальнейшие осложнения заболевания.[53]
Обычно диагноз ГКМП в педиатрической популяции ставится во время оценки шума, застойной сердечной недостаточности, физического истощения и генетического тестирования детей пострадавших людей.[53] В частности, эхокардиограмма (ЭХО) использовалась как окончательный неинвазивный диагностический инструмент почти у всех детей. ECHO оценивает размер желудочков сердца, толщину стенки, систолическую и диастолическую функцию, а также обструкцию оттока. Таким образом, ECHO был выбран в качестве идеального средства для обнаружения чрезмерного утолщения стенки сердечной мышцы при HCM.[53]
Стратегии лечения детей с ГКМП направлены на уменьшение симптомов болезни и снижение риска внезапной смерти.[55] Из-за неоднородности заболевания лечение обычно изменяется в соответствии с индивидуальными потребностями.[55] β-адреноблокаторы улучшают наполнение и расслабление левого желудочка и тем самым улучшают симптомы. У некоторых детей β-адреноблокаторы (например, пропранолол) показали свою эффективность в снижении риска внезапной смерти.[55] Кроме того, блокаторы кальциевых каналов (верапамил) и антиаритмические препараты могут использоваться в качестве дополнительной терапии к β-блокаторам у детей с симптомами. Тем не менее, необходимы дальнейшие испытания, чтобы определить их окончательные преимущества.[55]
Другие животные

Кошки
Гипертрофическая кардиомиопатия (ГКМП) у кошек является наиболее распространенным сердечное заболевание во внутреннем кошки;[56][57][58] Считается, что процесс заболевания и генетика аналогичны заболеванию человека.[59] В мейн-кун кошек, HCM был подтвержден как аутосомно-доминантный наследственный признак.[60] Многие породы кошек имеют HCM как проблему в породе.[61] Первая генетическая мутация (в сердечном миозин-связывающем протеине С), ответственная за ГКМП у кошек, была обнаружена в 2005 году у кошек мейн-кун.[62] Доступен тест на эту мутацию (A31P).[63] Около одной трети кошек мейн-кунов, протестированных на мутацию, являются либо гетерозиготными, либо гомозиготными по мутации, хотя многие из гетерозиготных кошек не имеют явных признаков заболевания на эхокардиограмме (низкая пенетрантность). У некоторых кошек мейн-кун с клиническими признаками гипертрофической кардиомиопатии тест отрицательный на эту мутацию, что убедительно свидетельствует о наличии другой причины в породе. Мутация сердечного миозин-связывающего протеина C, идентифицированная у кошек мейн-кун, не была обнаружена ни у одной другой породы кошек с HCM, но совсем недавно другая мутация миозин-связывающего протеина C была идентифицирована у кошек Ragdoll с HCM.[64][65] Как и у людей, HCM у кошек не присутствует при рождении, но со временем развивается. Впервые он был обнаружен у кошек в возрасте от 6 месяцев и, по крайней мере, от 7 лет.
Клинически кошки с гипертрофической кардиомиопатией обычно имеют систолическое переднее движение (SAM) митрального клапана (см. Рисунок).[66] У кошек с тяжелой формой ГКМП часто развивается левожелудочковая недостаточность (отек легких; плевральный выпот) из-за тяжелой диастолической дисфункции левого желудочка. У них также может развиться тромб левого предсердия, который эмболирует, чаще всего, в терминальную часть аорты, вызывая острую боль и паралич задних конечностей (см. Ниже). Внезапная смерть также может произойти, но это случается редко.[67][68]
УЗИ сердца (эхокардиография ) необходимо для диагностики ГКМП у кошек.[69][70][71] Измерение циркулирующего сердечного биомаркеры, как N ‐ terminal ‐ proBNP (NT ‐ proBNP )[72][73] и тропонин I (TnI) может использоваться у кошек для усиления подозрения на сердечное заболевание.[74] Существует Пункт обслуживания Доступен тест на кошачий NT-proBNP, который можно использовать в ветеринарной клинике, когда невозможно выполнить эхокардиографию.[75][76][77]
Лекарства от HCM у кошек нет. У многих, но не у всех кошек шумы в сердце. Многие кошки с шумом в сердце не имеют ГКМП. Часто первыми признаками ГКМП у кошки являются тахипноэ / одышка из-за сердечной недостаточности или острая боль и паралич из-за системной тромбоэмболии. Хотя лекарства обычно назначают кошкам с ГКМП, у которых нет клинических признаков, на этой стадии не было показано, что лекарства помогают, и было показано, что ингибитор АПФ бесполезен до тех пор, пока не появится сердечная недостаточность.[78] (когда мочегонное средство наиболее полезно). Дилтиазем обычно не дает очевидных преимуществ. Атенолол обычно применяется при сильном систолическом движении митрального клапана кпереди.
Артериальная тромбоэмболия кошек (FATE) - относительно частое и разрушительное осложнение HCM кошек и других кардиомиопатий кошек. Тромб обычно образуется в левом предсердии, чаще всего в левом предсердии. Считается, что образование происходит в первую очередь из-за застоя кровотока. Классически тромбоэмболия оседает на трехфуркации подвздошной кости аорты, закупоривая одну или обе общие подвздошные артерии. Поскольку это расщепление называется седловым тромбом и является наиболее частым местом образования тромба, судьба обычно известна как седловой тромб.[79] Клинически это проявляется как у кошки с полной потерей функции одной или обеих задних конечностей. Задние конечности холодные, кошка испытывает сильную боль. В редких случаях эмболы могут оседать в других местах, чаще всего в правой передней конечности и почечных артериях.
Клопидогрель используется, чтобы попытаться предотвратить образование тромба левого предсердия у кошек с HCM и большим левым предсердием. Исследование FATCAT в Университете Пердью продемонстрировало, что он превосходит аспирин в предотвращении образования второго тромба у кошек, которые уже испытали тромб. Тромболитические агенты (например, тканевой активатор плазминогена) с некоторым успехом использовались для устранения существующей тромбоэмболии аорты, но их стоимость высока, и результат, по-видимому, не лучше, чем дать кошке время (48-72 часа), чтобы разрушить ее собственный сгусток. Обезболивание чрезвычайно важно. Прогноз для кошек с FATE часто плохой, поскольку они, вероятно, уже имеют значительный HCM и вероятен повторный приступ FATE.[80] По этой причине эвтаназия часто является обоснованным соображением.
Гориллы
В июле 2013 года 42-летний Риго западная низменная горилла, проживающий в Зоопарк Мельбурна и отец Мзури, первой гориллы, рожденной искусственное оплодотворение, неожиданно умер в результате HCM. Это состояние не редкость у самцов горилл старше 30 лет, и во многих случаях признаки болезни отсутствуют до внезапной смерти человека.[81]
Рекомендации
- ^ «Другие названия кардиомиопатии». NHLBI. 22 июня 2016 г. В архиве из оригинала 28 июля 2016 г.. Получено 31 августа 2016.
- ^ а б c «Каковы признаки и симптомы кардиомиопатии?». NHLBI. 22 июня 2016. В архиве из оригинала 28 июля 2016 г.. Получено 10 ноября 2017.
- ^ а б c "Что такое кардиомиопатия?". NHLBI. 22 июня 2016. В архиве с оригинала 10 ноября 2017 г.. Получено 10 ноября 2017.
- ^ а б c Баршешет А., Бреньо А., Мосс А. Дж., Гольденберг I (октябрь 2011 г.). «Генетика внезапной сердечной смерти». Текущие кардиологические отчеты. 13 (5): 364–76. Дои:10.1007 / s11886-011-0209-y. PMID 21789574. S2CID 25887172.
- ^ а б c Ферри ФФ (2017). Электронная книга Ferri's Clinical Advisor 2018: 5 книг в 1. Elsevier Health Sciences. п. 246. ISBN 9780323529570. В архиве с оригинала на 2017-11-10. Получено 2017-11-10.
- ^ а б c "Что вызывает кардиомиопатию?". NHLBI. 22 июня 2016. В архиве из оригинала 5 октября 2017 г.. Получено 10 ноября 2017.
- ^ а б c d е ж грамм час я j k Gersh BJ, Maron BJ, Bonow RO, Dearani JA, Fifer MA, Link MS и др. (Декабрь 2011 г.). "Руководство ACCF / AHA 2011 г. по диагностике и лечению гипертрофической кардиомиопатии: краткое содержание: отчет Фонда Американского колледжа кардиологов / Целевой группы Американской кардиологической ассоциации по практическим рекомендациям". Журнал торакальной и сердечно-сосудистой хирургии. 142 (6): 1303–38. Дои:10.1016 / j.jtcvs.2011.10.019. PMID 22093712.
- ^ а б Марон Б.Дж., Оммен С.Р., Семзарян С., Спирито П., Олиготто И., Марон М.С. (июль 2014 г.). «Гипертрофическая кардиомиопатия: настоящее и будущее с переводом на современную сердечно-сосудистую медицину». Журнал Американского колледжа кардиологии. 64 (1): 83–99. Дои:10.1016 / j.jacc.2014.05.003. PMID 24998133.
- ^ а б c d е «Виды кардиомиопатии». NHLBI. 22 июня 2016. В архиве из оригинала 4 октября 2017 г.. Получено 10 ноября 2017.
- ^ а б c d е ж Басит, Хаджира; Брито, Даниэль; Шарма, Саураб (2020), "Гипертрофическая кардиомиопатия", StatPearls, Остров сокровищ (Флорида): StatPearls Publishing, PMID 28613539, получено 2020-09-20
- ^ Teare D (январь 1958 г.). «Асимметричная гипертрофия сердца у молодых людей». Британский журнал сердца. 20 (1): 1–8. Дои:10.1136 / час.20.1.1. ЧВК 492780. PMID 13499764.
- ^ Маккенна В.Дж., Сен-Чоудри С. (декабрь 2008 г.). «От Teare до наших дней: пятидесятилетняя одиссея гипертрофической кардиомиопатии, парадигма логики процесса открытия». Revista Espanola de Cardiologia. 61 (12): 1239–44. Дои:10.1016 / S1885-5857 (09) 60050-5. PMID 19080961. В архиве из оригинала на 11.11.2017. Получено 2017-02-06.
- ^ Марон Би Джей (март 2002 г.). «Гипертрофическая кардиомиопатия: систематический обзор». JAMA. 287 (10): 1308–20. Дои:10.1001 / jama.287.10.1308. PMID 11886323.
- ^ Файфер М.А., Влахакес Г.Дж. (январь 2008 г.). «Управление симптомами гипертрофической кардиомиопатии». Тираж. 117 (3): 429–39. Дои:10.1161 / CIRCULATIONAHA.107.694158. PMID 18212300.
- ^ Боноу Р., Браунвальд Э, Зипес Д. П., Либби П. (2005). «Кардиомиопатии». Болезнь Браунвальда: учебник сердечно-сосудистой медицины (7-е изд.). Филадельфия: У. Б. Сондерс. ISBN 978-1-4160-0014-3.
- ^ Вигл Э.Д., Раковски Х., Кимбалл Б.П., Уильямс РГ (октябрь 1995 г.). «Гипертрофическая кардиомиопатия. Клинический спектр и лечение». Тираж. 92 (7): 1680–92. Дои:10.1161 / 01.cir.92.7.1680. PMID 7671349.
- ^ а б c Марон Б.Дж., МакКенна В.Дж., Дэниэлсон Г.К., Каппенбергер Л.Дж., Кун Г.Дж., Зейдман К.Э. и др. (Ноябрь 2003 г.). «Документ о консенсусе клинических экспертов Американского колледжа кардиологов / Европейского общества кардиологов по гипертрофической кардиомиопатии. Отчет Целевой группы Фонда Американского колледжа кардиологов о документах консенсуса клинических экспертов и Практические рекомендации Комитета кардиологов Европейского общества». Журнал Американского колледжа кардиологии. 42 (9): 1687–713. Дои:10.1016 / S0735-1097 (03) 00941-0. PMID 14607462.
- ^ Калива А., Партенакис Ф.И., Маркетоу М.Э., Контараки Ю.Э., Вардас ЧП (апрель 2014 г.). «Биохимическая характеристика мутаций тропонина С, вызывающих гипертрофические и дилатационные кардиомиопатии». Журнал исследований мышц и подвижности клеток. 35 (2): 161–78. Дои:10.1007 / s10974-014-9382-0. PMID 24744096. S2CID 1726747.
- ^ Мерфи Дж. Г., Ллойд М. А. (2007). Краткий учебник по кардиологии клиники Мэйо и обзорные вопросы и ответы Совета по кардиологии клиники Мэйо: (ТЕКСТ И НАБОР ВОПРОСОВ). CRC Press. п. 1159. ISBN 9781439825457. В архиве из оригинала на 2018-10-23. Получено 2018-10-22.
- ^ Чирино А.Л., Хо С (2014). «Обзор гипертрофической кардиомиопатии». В: Adam MP, Ardinger HH, Pagon RA, Wallace SE, Bean LJ, Stephens K, Amemiya A (ред.). GeneReviews. Вашингтонский университет, Сиэтл. PMID 20301725.
- ^ Дулан Дж., Нгуен Л., Чанг Дж., Инглес Дж., Семзарян К. (август 2004 г.). «Прогрессирование гипертрофии левого желудочка и полиморфизм гена ангиотензинпревращающего фермента при гипертрофической кардиомиопатии». Международный журнал кардиологии. 96 (2): 157–63. Дои:10.1016 / j.ijcard.2004.05.003. PMID 15314809.
- ^ Мариан А.Дж., Ю.К.Т., Уоркман Р., Греве Г., Робертс Р. (октябрь 1993 г.). «Полиморфизм ангиотензин-превращающего фермента при гипертрофической кардиомиопатии и внезапной сердечной смерти». Ланцет. 342 (8879): 1085–6. Дои:10.1016 / 0140-6736 (93) 92064-Z. PMID 8105312. S2CID 39088276.
- ^ Паскуале Ф., Сиррис П., Каски Дж. П., Могенсен Дж., МакКенна В. Дж., Эллиотт П. (февраль 2012 г.). «Отдаленные результаты гипертрофической кардиомиопатии, вызванной мутациями в гене сердечного тропонина Т». Тираж. Сердечно-сосудистая генетика. 5 (1): 10–7. Дои:10.1161 / CIRCGENETICS.111.959973. PMID 22144547.
- ^ Седагхат-Хамедани Ф., Кайванпур Э., Тугрул О.Ф., Лай А., Амр А., Хаас Дж. И др. (Январь 2018). «Клинические результаты, связанные с саркомерными мутациями при гипертрофической кардиомиопатии: метаанализ на 7675 человек». Клинические исследования в кардиологии. 107 (1): 30–41. Дои:10.1007 / s00392-017-1155-5. PMID 28840316. S2CID 23723131.
- ^ Cheng Y, Regnier M (июль 2016 г.). «Структура-функция сердечного тропонина и влияние мутаций, связанных с гипертрофической кардиомиопатией, на модуляцию сократительной способности». Архивы биохимии и биофизики. 601: 11–21. Дои:10.1016 / j.abb.2016.02.004. ЧВК 4899195. PMID 26851561.
- ^ а б Голлоб М.Х., Блиер Л., Бругада Р., Шампанское Дж., Чаухан В., Коннорс С. и др. (2011). «Рекомендации по использованию генетического тестирования в клинической оценке наследственных сердечных аритмий, связанных с внезапной сердечной смертью: совместный документ с изложением позиции Канадского сердечно-сосудистого общества / Канадского общества сердечного ритма». Канадский журнал кардиологии. 27 (2): 232–45. Дои:10.1016 / j.cjca.2010.12.078. PMID 21459272.
- ^ Амано Ю., Китамура М., Такано Х., Янагисава Ф., Тачи М., Сузуки Ю. и др. (Апрель 2018). «Кардиологическая МРТ гипертрофической кардиомиопатии: методы, результаты и клиническая значимость». Магнитный резонанс в медицинских науках. 17 (2): 120–131. Дои:10.2463 / mrms.rev.2017-0145. ЧВК 5891337. PMID 29343659.
- ^ Сиверт Х., Куреши С.А., Уилсон Н., Хиджази З.М. (2015). Вмешательства при структурных, клапанных и врожденных пороках сердца (второе изд.). CRC Press. п. 46. ISBN 9781482215649. В архиве из оригинала на 2018-01-03. Получено 2018-01-02.
- ^ Ривера-Диас Дж., Моосви А.Р. (июль 1996 г.). «Апикальная гипертрофическая кардиомиопатия». Южный медицинский журнал. 89 (7): 711–3. Дои:10.1097/00007611-199607000-00012. PMID 8685759.
- ^ а б c d е ж Марон Би Джей (март 2002 г.). «Гипертрофическая кардиомиопатия: систематический обзор». JAMA. 287 (10): 1308–20. Дои:10.1001 / jama.287.10.1308. PMID 11886323.
- ^ а б c d е ж Behr ER, McKenna WJ (декабрь 2002 г.). "Гипертрофическая кардиомиопатия". Современные варианты лечения в сердечно-сосудистой медицине. 4 (6): 443–453. Дои:10.1007 / s11936-002-0039-8. PMID 12408787. S2CID 8041261.
- ^ Коррадо Д., Бассо К., Павей А., Мичели П., Скьявон М., Тьене Г. (октябрь 2006 г.). «Тенденции внезапной сердечно-сосудистой смерти у молодых конкурентоспособных спортсменов после реализации программы предварительного обследования». JAMA. 296 (13): 1593–601. Дои:10.1001 / jama.296.13.1593. PMID 17018804.
- ^ Critoph C, Elliott P (декабрь 2010 г.). "Гипертрофическая кардиомиопатия". Клиники кардиологической электрофизиологии. 2 (4): 587–598. Дои:10.1016 / j.ccep.2010.09.010. PMID 28770721.
- ^ а б Germans T, Wilde AA, Dijkmans PA, Chai W., Kamp O, Pinto YM, van Rossum AC (декабрь 2006 г.). «Структурные аномалии инферосептальной стенки левого желудочка, обнаруженные с помощью магнитно-резонансной томографии сердца у носителей мутаций гипертрофической кардиомиопатии». Журнал Американского колледжа кардиологии. 48 (12): 2518–23. Дои:10.1016 / j.jacc.2006.08.036. PMID 17174192.
- ^ а б c d Coats CJ, Elliott PM (декабрь 2008 г.). «Современное лечение гипертрофической кардиомиопатии». Современные варианты лечения в сердечно-сосудистой медицине. 10 (6): 496–504. Дои:10.1007 / s11936-008-0042-9. PMID 19026180. S2CID 318803.
- ^ а б Марон Би Джей (март 2010 г.). «Национальный скрининг электрокардиографии для конкурентоспособных спортсменов: возможно ли в Соединенных Штатах?». Анналы внутренней медицины. 152 (5): 324–6. CiteSeerX 10.1.1.668.3787. Дои:10.7326/0003-4819-152-5-201003020-00012. PMID 20194239. S2CID 37588552.
- ^ Марон Б.Дж., Дерер Дж.Дж., Хаас Т.С., Тирни Д.М., Мюллер Ф.О. (март 2009 г.). «Внезапные смерти молодых конкурентоспособных спортсменов: анализ 1866 смертей в США, 1980-2006 гг.». Тираж. 119 (8): 1085–92. Дои:10.1161 / CIRCULATIONAHA.108.804617. PMID 19221222.
- ^ Марон Б.Дж., Гохман Т.Е., Эппли Д. (декабрь 1998 г.). «Распространенность внезапной сердечной смерти во время соревновательных спортивных мероприятий у спортсменов средней школы Миннесоты». Журнал Американского колледжа кардиологии. 32 (7): 1881–4. Дои:10.1016 / S0735-1097 (98) 00491-4. PMID 9857867.
- ^ Hershberger RE, Lindenfeld J, Mestroni L, Seidman CE, Taylor MR, Towbin JA (март 2009 г.). «Генетическая оценка кардиомиопатии - практическое руководство Американского общества сердечной недостаточности». Журнал сердечной недостаточности. 15 (2): 83–97. Дои:10.1016 / j.cardfail.2009.01.006. HDL:1805/15853. PMID 19254666.
- ^ Espinoza J (31 января 2016 г.). «Сын сэра Дэвида Фроста не подозревает о смертельной болезни сердца.'". Daily Telegraph. В архиве с оригинала на 20 января 2019 г.. Получено 1 февраля 2016.
- ^ Шерид М.В., Чаудри Ф.А., Swistel DG (февраль 2003 г.). «Обструктивная гипертрофическая кардиомиопатия: эхокардиография, патофизиология и продолжающаяся эволюция хирургии обструкции». Летопись торакальной хирургии. 75 (2): 620–32. Дои:10.1016 / S0003-4975 (02) 04546-0. PMID 12607696.
- ^ Мессмер Би Джей (август 1994 г.). «Расширенная миэктомия при гипертрофической обструктивной кардиомиопатии». Летопись торакальной хирургии. 58 (2): 575–7. Дои:10.1016/0003-4975(94)92268-3. PMID 8067875.
- ^ Schoendube FA, Klues HG, Reith S, Flachskampf FA, Hanrath P, Messmer BJ (ноябрь 1995 г.). «Долгосрочное клинико-эхокардиографическое наблюдение после хирургической коррекции гипертрофической обструктивной кардиомиопатии с расширенной миэктомией и реконструкцией подклапанного митрального аппарата». Тираж. 92 (9 Прил.): II122-7. Дои:10.1161 / 01.CIR.92.9.122. PMID 7586394.
- ^ а б Баларам С.К., Шерид М.В., Дерос Дж. Дж., Хиллель З., Винсон Дж., Swistel DG (июль 2005 г.). «Помимо расширенной миэктомии при гипертрофической кардиомиопатии: восстановление после резекции-пликации-высвобождения (RPR)». Летопись торакальной хирургии. 80 (1): 217–23. Дои:10.1016 / j.athoracsur.2005.01.064. PMID 15975370.
- ^ Зигварт У (июль 1995 г.). «Безоперационное уменьшение миокарда при гипертрофической обструктивной кардиомиопатии». Ланцет. 346 (8969): 211–4. Дои:10.1016 / S0140-6736 (95) 91267-3. PMID 7616800. S2CID 32959772.
- ^ Heldman AW, Wu KC, Abraham TP, Cameron DE (январь 2007 г.). «Миэктомия или операция по удалению межпозвоночной перегородки и чрескожное вмешательство - это еще один раунд». Журнал Американского колледжа кардиологии. 49 (3): 358–60. Дои:10.1016 / j.jacc.2006.10.029. PMID 17239718.
- ^ Димитроу П.П., Раджтар-Салва Р. (май 2016 г.). «Обструктивная форма гипертрофической кардиомиопатии - градиент оттока левого желудочка: новые методы провокации, мониторинг биомаркеров и последние достижения в лечении». BioMed Research International. 2016: 1575130. Дои:10.1155/2016/1575130. ЧВК 4877458. PMID 27247935.
- ^ Сораджа П., Педерсен В.А., Бэ Р., Лессер Дж. Р., Джей Д., Лин Д. и др. (Июнь 2016). «Первый опыт чрескожной имплантации митрального клапана в качестве первичной терапии симптоматической обструктивной гипертрофической кардиомиопатии». Журнал Американского колледжа кардиологии. 67 (24): 2811–8. Дои:10.1016 / j.jacc.2016.03.587. PMID 27311518.
- ^ Оммен С.Р., Нишимура Р.А., Сквайрс Р.В., Шафф Х.В., Дэниэлсон Г.К., Таджикский А.Дж. (июль 1999 г.). «Сравнение двухкамерной кардиостимуляции и септальной миэктомии для лечения пациентов с гипертрофической обструктивной кардиомиопатией: сравнение объективных конечных точек гемодинамики и физической нагрузки». Журнал Американского колледжа кардиологии. 34 (1): 191–6. Дои:10.1016 / S0735-1097 (99) 00173-4. PMID 10400010.
- ^ Марон Б.Дж., Спирито П., Шен В.К., Хаас Т.С., Формизано Ф., Линк М.С. и др. (Июль 2007 г.). «Имплантируемые кардиовертеры-дефибрилляторы и профилактика внезапной сердечной смерти при гипертрофической кардиомиопатии». JAMA. 298 (4): 405–12. Дои:10.1001 / jama.298.4.405. PMID 17652294.
- ^ «ИКД и кардиостимуляторы». Ассоциация гипертрофической кардиомиопатии. В архиве с оригинала 15 ноября 2016 г.. Получено 14 ноября, 2016.
- ^ Рекомендации ESC 2014 г. по диагностике и лечению гипертрофической кардиомиопатии
- ^ а б c d Colan SD (октябрь 2010 г.). «Гипертрофическая кардиомиопатия в детстве». Клиники сердечной недостаточности. 6 (4): 433–44, vii – iii. Дои:10.1016 / j.hfc.2010.05.004. ЧВК 2946944. PMID 20869644.
- ^ Lipshultz SE, Sleeper LA, Towbin JA, Lowe AM, Orav EJ, Cox GF и др. (Апрель 2003 г.). «Заболеваемость детской кардиомиопатией в двух регионах США». Медицинский журнал Новой Англии. 348 (17): 1647–55. Дои:10.1056 / NEJMoa021715. PMID 12711739.
- ^ а б c d Маскатия С.А. (2012). «Гипертрофическая кардиомиопатия: младенцы, дети и подростки». Врожденный порок сердца. 7 (1): 84–92. Дои:10.1111 / j.1747-0803.2011.00613.x. PMID 22222117.
- ^ Пейн-младший, Бродбельт, округ Колумбия, Луис Фуэнтес V (декабрь 2015 г.). «Распространенность кардиомиопатии у 780 практически здоровых кошек в центрах переселения (исследование CatScan)» (PDF). Журнал ветеринарной кардиологии. 17 Приложение 1: S244-57. Дои:10.1016 / j.jvc.2015.03.008. PMID 26776583.
- ^ Пейдж К.Ф., Эбботт Дж. А., Эльвинджер Ф., Пайл Р. Л. (июнь 2009 г.). «Распространенность кардиомиопатии у практически здоровых кошек». Журнал Американской ветеринарной медицинской ассоциации. 234 (11): 1398–403. Дои:10.2460 / javma.234.11.1398. HDL:10919/43704. PMID 19480619.
- ^ Вагнер Т., Фуэнтес В.Л., Пейн Дж. Р., МакДермотт Н., Бродбельт Д. (декабрь 2010 г.). «Сравнение результатов аускультативных и эхокардиографических исследований у здоровых взрослых кошек». Журнал ветеринарной кардиологии. 12 (3): 171–82. Дои:10.1016 / j.jvc.2010.05.003. PMID 21075067.
- ^ «Гипертрофическая кардиомиопатия (ГКМП) у кошек». Больница Корнельского университета для животных. В архиве из оригинала 22 января 2018 г.. Получено 24 февраля 2017.
- ^ Kittleson MD, Meurs KM, Munro MJ, Kittleson JA, Лю С.К., Pion PD, Towbin JA (июнь 1999 г.). «Семейная гипертрофическая кардиомиопатия у кошек породы мейн-кун: модель человеческого заболевания на животных». Тираж. 99 (24): 3172–80. Дои:10.1161 / 01.CIR.99.24.3172. PMID 10377082.
- ^ Киттлсон М., Гомпф Р., Литтл С. «Гипертрофическая кардиомиопатия кошек: советы заводчикам». Ассоциация любителей кошек. Архивировано из оригинал 13 мая 2008 г.
- ^ Meurs KM, Sanchez X, David RM, Bowles NE, Towbin JA, Reiser PJ и др. (Декабрь 2005 г.). «Мутация сердечного миозин-связывающего протеина С у кошки мейн-кун с семейной гипертрофической кардиомиопатией». Молекулярная генетика человека. 14 (23): 3587–93. Дои:10.1093 / hmg / ddi386. PMID 16236761.
- ^ «Генетика: гипертрофическая кардиомиопатия у кошек мейн-кун». Университет штата Северная Каролина, Колледж ветеринарной медицины. В архиве с оригинала 3 сентября 2019 г.. Получено 29 декабря, 2016.
- ^ Мерс К.М., Норгард М.М., Эдерер М.М., Хендрикс К.П., Киттлсон М.Д. (август 2007 г.). «Мутация замещения в гене миозин-связывающего протеина С при гипертрофической кардиомиопатии рэгдолла». Геномика. 90 (2): 261–4. Дои:10.1016 / j.ygeno.2007.04.007. PMID 17521870.
- ^ "Генетика: гипертрофическая кардиомиопатия Рэгдолла". Университет штата Северная Каролина, Колледж ветеринарной медицины. В архиве с оригинала 14 декабря 2016 г.. Получено 29 декабря, 2016.
- ^ Шобер К., Тодд А. (апрель 2010 г.). «Эхокардиографическая оценка геометрии левого желудочка и аппарата митрального клапана у кошек с гипертрофической кардиомиопатией». Журнал ветеринарной кардиологии. 12 (1): 1–16. Дои:10.1016 / j.jvc.2009.09.004. PMID 20185379.
- ^ Fox PR, Keene BW, Lamb K, Schober KA, Chetboul V, Luis Fuentes V и др. (Май 2018). «Международное совместное исследование по оценке риска сердечно-сосудистых заболеваний и долгосрочного здоровья кошек с доклинической гипертрофической кардиомиопатией и практически здоровых кошек: исследование REVEAL». Журнал внутренней ветеринарной медицины. 32 (3): 930–943. Дои:10.1111 / jvim.15122. ЧВК 5980443. PMID 29660848.
- ^ Fox PR, Keene BW, Lamb K, Schober KE, Chetboul V, Luis Fuentes V и др. (Ноябрь 2019 г.). «Долгосрочная частота и риск несердечно-сосудистой и общей смертности у практически здоровых кошек и кошек с доклинической гипертрофической кардиомиопатией». Журнал внутренней ветеринарной медицины. 33 (6): 2572–2586. Дои:10.1111 / jvim.15609. ЧВК 6872868. PMID 31605422.
- ^ Луис Фуэнтес V, Уилки LJ (сентябрь 2017 г.). «Бессимптомная гипертрофическая кардиомиопатия: диагностика и терапия» (PDF). Ветеринарные клиники Северной Америки. Практика мелких животных. 47 (5): 1041–1054. Дои:10.1016 / j.cvsm.2017.05.002. PMID 28662873.
- ^ Хэггстрем Дж, Луис Фуэнтес В., Весс Дж. (Декабрь 2015 г.). «Скрининг гипертрофической кардиомиопатии у кошек». Журнал ветеринарной кардиологии. 17 Дополнение 1: С134-49. Дои:10.1016 / j.jvc.2015.07.003. PMID 26776573.
- ^ Луис Фуэнтес V, Abbott J, Chetboul V, Côté E, Fox PR, Häggström J и др. (Май 2020 г.). «Рекомендации ACVIM по классификации, диагностике и лечению кардиомиопатий у кошек». Журнал внутренней ветеринарной медицины. 34 (3): 1062–1077. Дои:10.1111 / jvim.15745. ЧВК 7255676. PMID 32243654.
- ^ Fox PR, Rush JE, Reynolds CA, Defrancesco TC, Keene BW, Atkins CE и др. (Сентябрь 2011 г.). «Многоцентровая оценка N-концевого натрийуретического пептида пробрена в плазме (NT-pro BNP) в качестве биохимического скринингового теста на бессимптомную (скрытую) кардиомиопатию у кошек». Журнал внутренней ветеринарной медицины. 25 (5): 1010–6. Дои:10.1111 / j.1939-1676.2011.00776.x. PMID 21985136.
- ^ Wess G, Daisenberger P, Mahling M, Hirschberger J, Hartmann K (июнь 2011 г.). «Полезность измерения N-концевого натрийуретического пептида мозга в плазме для выявления гипертрофической кардиомиопатии и дифференциации степени тяжести у кошек». Ветеринарная клиническая патология. 40 (2): 237–44. Дои:10.1111 / j.1939-165X.2011.00305.x. PMID 21434959.
- ^ Borgeat K, Connolly DJ, Луис Фуэнтес V (декабрь 2015 г.). «Сердечные биомаркеры у кошек» (PDF). Журнал ветеринарной кардиологии. 17 Приложение 1: С74-86. Дои:10.1016 / j.jvc.2015.08.001. PMID 26776596.
- ^ Hanås S, Holst BS, Höglund K, Häggström J, Tidholm A, Ljungvall I (май 2020 г.). «Влияние характеристик кошачьих на концентрацию натрийуретического пептида N-концевого прогормона B-типа в плазме и сравнение теста в месте оказания медицинской помощи и теста ELISA». Журнал внутренней ветеринарной медицины. 34 (3): 1187–1197. Дои:10.1111 / jvim.15754. ЧВК 7255655. PMID 32200578.
- ^ Machen MC, Oyama MA, Gordon SG, Rush JE, Achen SE, Stepien RL, et al. (Декабрь 2014 г.). «Многоцентровое исследование анализа NT-proBNP ELISA в месте оказания медицинской помощи для выявления скрытых (доклинических) заболеваний сердца кошек от умеренной до тяжелой степени у кошек, направленных на кардиологическое обследование». Журнал ветеринарной кардиологии. 16 (4): 245–55. Дои:10.1016 / j.jvc.2014.09.002. PMID 25456274.
- ^ Харрис А.Н., Битти С.С., Эстрада А.Х., Винтер Б., Боханнон М., Соса I и др. (Июль 2017 г.). "Исследование N-концевого прогормона мозгового натрийуретического пептида в точках наблюдения ELISA у клинически нормальных кошек и кошек с сердечными заболеваниями". Журнал внутренней ветеринарной медицины. 31 (4): 994–999. Дои:10.1111 / jvim.14776. ЧВК 5508306. PMID 28617995.
- ^ Макдональд К.А., Киттлсон, доктор медицины, Ларсон Р.Ф., Касс П., Клозе Т., Виснер Е.Р. (2006). «Влияние рамиприла на массу левого желудочка, фиброз миокарда, диастолическую функцию и нейрогормоны плазмы у кошек породы мейн-кун с семейной гипертрофической кардиомиопатией без сердечной недостаточности». Журнал внутренней ветеринарной медицины. 20 (5): 1093–105. Дои:10.1111 / j.1939-1676.2006.tb00707.x. PMID 17063701.
- ^ «Хрупкая судьба судьбы: лечение и прогноз тромбоэмболии аорты у кошек». Массачусетское общество по предотвращению жестокого обращения с животными-Энджелл. В архиве с оригинала 9 октября 2018 г.. Получено 8 октября, 2016.
- ^ Боргеат К., Райт Дж., Гаррод О, Пейн Дж. Р., Фуэнтес В. Л. (2014). «Артериальная тромбоэмболия у 250 кошек общей практики: 2004-2012 гг.». Журнал внутренней ветеринарной медицины. 28 (1): 102–8. Дои:10.1111 / jvim.12249. ЧВК 4895537. PMID 24237457.
- ^ Смит Б. (26 июля 2013 г.). «Серебрянная горилла Риго умерла от сердечной недостаточности в зоопарке Мельбурна». Возраст. В архиве из оригинала на 03.01.2017. Получено 2013-07-26.
внешняя ссылка
| Классификация | |
|---|---|
| Внешние ресурсы |
