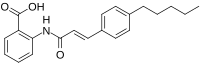
N- (п-амилциннамоил) антраниловая кислота - N-(p-Amylcinnamoyl)anthranilic acid
 | |
| Имена | |
|---|---|
| Название ИЮПАК 2-[[(E) -3- (4-пентилфенил) проп-2-еноил] амино] бензойная кислота | |
Другие имена
| |
| Идентификаторы | |
3D модель (JSmol ) | |
| ECHA InfoCard | 100.189.123 |
PubChem CID | |
| |
| Характеристики | |
| C21ЧАС23NО3 | |
| Молярная масса | 337.419 г · моль−1 |
| Внешность | Порошок от белого до кремового[1] |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
N-(п-Амилциннамоил) антраниловая кислота (ACA) является модулятором различных ионные каналы в сердце. АСА - эффективный обратимый ингибитор кальций-активируемого хлоридные каналы и, в меньшей степени, хлоридные каналы, активируемые цАМФ, не влияя на Кальциевые каналы L-типа.[2] Считается, что хлоридные каналы, активируемые кальцием, участвуют в развитии аритмии.[2][3]
Аритмия
Аритмия - сердечное заболевание, характеризующееся нерегулярным сердцебиением. Некоторые формы аритмии опасны и опасны для жизни, в то время как другие сравнительно незначительны. Клетки сердца (сердечные миоциты ) сокращаются из-за увеличения заряда через мембрану (деполяризация ), что порождает потенциал действия. Нерегулярные сокращения могут вызвать аритмию.[3][4]
Хлоридные каналы, активируемые кальцием
Активированный кальцием хлоридный канал присутствует в сердечных миоцитах многих видов, например, кроличьих.[5][6] и свинья,[2][7] но их присутствие в сердечных миоцитах человека обсуждается. Некоторые представили доказательства того, что эти каналы присутствуют в клетках предсердий человека,[8] в то время как другие не смогли найти подобных результатов.[9]
Хлоридный канал, активируемый кальцием, является важным компонентом на ранней стадии реполяризация (возвращая заряд через мембрану в норму) клеток сердечной мышцы,[10] способствуя формированию плато во время потенциала действия.[7] Когда сердце находится в состоянии покоя, ток хлоридного канала может активироваться, вызывая выход хлорида наружу, вызывая деполяризующий ток. Этот ток обычно достаточно велик, чтобы генерировать потенциал действия, называемый отложенной постдеполяризацией. Отсроченная постдеполяризация может привести к аритмиям.[3][11] Поскольку хлоридный канал связывается и активируется кальцием, это чаще встречается в клетках, которые уже находятся в состоянии кальциевого стресса.[11] Активируемый кальцием хлоридный ток также удваивается при стимуляции Симпатическая нервная система, вероятно, из-за увеличения высвобождения кальция, хотя канал потенциально может находиться под прямым контролем симпатической нервной системы.[3]
Лечение аритмии
Из-за способности активированного кальцием хлоридного канала вызывать аритмию, блокировка канала может привести к антиаритмогенному действию. Блокирование кальциевого тока снижает амплитуды отсроченной постдеполяризации в достаточной степени, чтобы предотвратить генерацию потенциала действия.[3] Было показано, что АСА подавляет ток хлоридов, активируемый кальцием, но этот эффект обратим после удаления препарата. АСА может также ингибировать гиперполяризацию клетки, продлевая потенциал действия. ACA имеет потенциал как антиаритмогенное средство,[2][3] а также инструмент для дальнейшего изучения хлоридных каналов.[2]
Рекомендации
- ^ «N- (п-Амилциннамоил) антраниловая кислота». Сигма-Олдрич.
- ^ а б c d е Gwanyanya A, Macianskiene R, Bito V, Sipido KR, Vereecke J, Mubagwa K. "Ингибирование кальций-активированного хлоридного тока в миоцитах желудочков сердца с помощью N- (p-амилциннамоил) антраниловой кислоты (ACA)". Biochem Biophys Res Commun 2010;402:531–536.
- ^ а б c d е ж Verkerk A, Veldkamp M, Bouman L, van Ginneken A. «Активированный кальцием Cl− Ток способствует задержке деполяризации в одиночных пуркинье и миоцитах желудочков ». Тираж 2000;101:2639–2644.
- ^ Гайтон А., Холл Дж. Учебник медицинской физиологии, Десятое изд. Филадельфия, Пенсильвания: W.B. Компания Saunders, 2000 г.
- ^ Зигмунт А.С., Гиббонс В.Р. «Кальций-активированный хлоридный ток в миоцитах желудочков кролика». Circ Res 1991:68:424–437.
- ^ Сипидо KR, Callewaert G, Carmeliet E. "[Ca2+] i переходные процессы и [Ca2+] i-зависимый хлоридный ток в одиночных клетках Пуркинье из сердца кролика ». J Physiol 1993;468:641–667.
- ^ а б Ли GR, Du XL, Siow YL, O K, Tse HF, Lau CP. «Активированный кальцием переходный исходящий хлоридный ток и фаза 1 реполяризации потенциала действия желудочков свиней». Cardiovasc Res 2003;58:89–98.
- ^ Escande D, Coulombe A, Faivre JF, Deroubaix E, Coraboeuf E. "Два типа переходных исходящих токов в предсердных клетках взрослого человека". Am J Physiol 1987; 252: H143 – H148.
- ^ Ли Г.Р., Фэн Дж., Ван З., Фермини Б., Наттель С. «Сравнительные механизмы 4-аминопиридин-резистентного Ито в миоцитах предсердий человека и кролика». Am J Physiol 1995; 269: H463 – H472.
- ^ Кеньон Дж. Л., Гиббонс В. Р.. «4-Аминопиридин и ранний выход сердечных волокон Пуркинье овец». J Gen Physiol 1979;73:139–157.
- ^ а б Зигмунт А.С., Гудроу Р.Дж., Вайгель СМ. «INaCa и ICl (Ca) вносят вклад в индуцированную изопротеренолом задержку деполяризации в клетках средней части миокарда». Am J Physiol 1998; 275: H1979 – H1992.
