Фенилтропан - Phenyltropane
Фенилтропаны (PT) изначально были разработаны для уменьшения кокаин зависимость и зависимость.[2][3] Обычно эти соединения действуют как ингибиторы плазмалемма моноамин обратный захват транспортеры. Несмотря на то что RTI занимает сильные позиции в этой области,[нужна цитата ] они не Только исследователи, подготовившие эти аналоги. Это исследование продолжалось более двух последних десятилетий и в последнее время набирает обороты, создавая многочисленные фенилтропаны как исследование аналоги кокаина вызывает интерес к лечению зависимости.
Использует
Зависимость
Соединения фенилтропана были первоначально открыты R. Clarke et al. во время исследования, чтобы попытаться отделить стимулирующие свойства кокаина от его склонности к злоупотреблению и зависимости.[4][5] Было показано, что первые простые фенилтропаны (WIN 35065-2 и WIN 34,428) активны в поведенческих анализах только для ββ-изомеров. Активность соответствующих αβ-изомеров разочаровывала.
Позже было показано, что WIN 35065-2 и WIN 34,428 в основном дофамин селективные ингибиторы обратного захвата с некоторыми остаточными действиями на переносчик норэпинефрина (NET) и переносчик серотонина (SERT). В нейротрансмиттер дофамин является ключевым кандидатом для объяснения усиливающих действий препаратов.[6][7] Неясно, в какой степени NET участвует в подкрепляющих действиях кокаин (ан SNDRI ).[8] Исследования на животных показывают доказательства того, что ингибирование SERT может снизить потребление кокаина.[9]
Исследования на животных на обезьянах и крысах пытались оценить способность аналогов фенилтропана к самостоятельному введению наряду с кокаином. Часто аналоги вводят до начала сеанса, чтобы увидеть, могут ли они подавить реакцию рычага кокаина. Большинство аналогов ведут себя типично для DRI. В частности, они стимулируют двигательную активность и вызывают неселективное снижение потребления кокаина по сравнению с едой.[10] В дозе, которая может снизить потребление кокаина, большинство аналогов требует высокой занятости DAT.[11] Это будет означать, что агонисты должны быть поведенчески активными в дозе, которая может вызвать снижение тяги к кокаину. Большинство аналогов легко заменят кокаин, хотя большинство из них не вызывают столько ответных реакций за сеанс из-за фармакокинетических факторов.[12] Поскольку эти агонисты действуют как подкрепляющие элементы, существует очевидная проблема их ответственности за злоупотребления.
Тем не менее, медленное начало действия агонистов длительного действия кажется разумным подходом. Фенилтропаны широко используются в исследованиях на животных наркотическая зависимость так как они разделяют стимулирующие свойства и усиливающие эффекты кокаина, но с более высокой эффективностью, менее неспецифическим связыванием, что позволяет избежать кардиотоксичность связанный с кокаином.[13]
РТИ-336 представляет собой интересный пример фенилтропана, который исследуется в контексте лечения кокаиновой зависимости.[14] RTI-336 является DRI и, следовательно, специально нацелен на DAT, который отвечает за вызывающие привыкание свойства кокаина. Хотя может быть роль ингибирования NET и ацетилхолинергического действия, очевидно, что именно DA является критическим нейромедиатором. Дофамин является биологическим предшественником норадреналина. DA производится из тирозин, который является заменимая аминокислота учитывая, что это может быть сделано из фенилаланин.
Более подтвержденная привычка к выработке метамфетамина является более серотонинергической, чем менее усиливающий амфетамин. Большинство современных исследований показывают, что 5-HT отрицательно коррелируя с потенциалом психостимуляторов к формированию зависимости, это не означает, что свойства НИИ нельзя считать полезными. Фактически, вышеизложенное было доказано Ротманом для выпуска агентов под PAL-287 программа родственных молекул. Что было в некоторой степени интересно, так это то, что хотя причина отсутствия усиления РТИ-112 сейчас хорошо известна, тесно связана РТИ-111 был способен вести себя так, как это могло быть типично для неселективных SNDRI, таких как кокаин. Роль сети не является полностью пагубной. В недавней статье Ротмана о субстратах-транспортерах он устанавливает, что для высвобождающих веществ, подобных амфетамину, дискриминационный стимул более точно определяется высвобождением NE, чем высвобождением DA. Этот аргумент не смягчает аргументы против важности DA, но наводит на мысль, что катехоламин в целом это важно. точное соотношение составляет 50:50 в случае метилфенидата.
Дезипрамин и атомоксетин однако, не являются надежными самовоспроизводящимися, в отличие от большинства селективных DRI. СИОЗС также нельзя принимать самостоятельно. Следовательно, следует иметь в виду, что эти нейротрансмиттеры вряд ли участвуют в формировании зависимости от кокаина и связанных с ним стимуляторов. Тем не менее, они по-прежнему активны в поведении и будут способствовать эффектам, которые такие наркотики вызывают у своих потребителей.
Следует иметь в виду беспорядочные связи между перевозчиками. Транспортеры моноаминов могут транспортировать нейротрансмиттеры, отличные от их «естественного» нейромедиатора.[15] Например, в ядре (или оболочке?) префронтальная кора там, где количество DAT невелико, вместо этого DA транспортируется по NET. Следовательно, селективные NRI, такие как атомоксетин, способны увеличивать концентрацию надклеточного (синаптического) DA в этой области мозга посредством NET-блокады.[нужна цитата ]
Исключение сродства SERT и NET желательно в контексте того, что эти молекулярные мишени менее актуальны для целей программы лечения, заключающейся в сокращении потребления кокаина. Хорошо видно, что RTI-336 имеет меньше метаболически лабильных участков, чем кокаин, и, следовательно, имеет более длительный период действия.
Связывающие лиганды
Эти соединения в основном используются в научных исследованиях, так как их высокий сродство связывания для транспортеров моноаминов, а также широкий спектр радиоактивно меченый Доступные фенилтропановые соединения с различной специфичностью связывания делают их очень полезными для картирования распределения различных переносчиков моноаминов в головном мозге.
Другое использование
Некоторые производные фенилтропана также были исследованы для использования в медицине при лечении таких состояний, как болезнь Паркинсона[16] и Болезнь Альцгеймера, депрессия, и их сильные подавитель аппетита эффекты делают их многообещающими кандидатами для облегчения похудания при лечении ожирение.
Отношения структура-деятельность
Селективность транспортера
Соединения известны с ярко выраженной селективностью по каждому МАТ - дофамин,[14] норадреналин[17] и переносчик серотонина.[18]
На основе фенилтропана »SNDRI 's "- еще одна возможность.[2][3]
Изомеры исследования
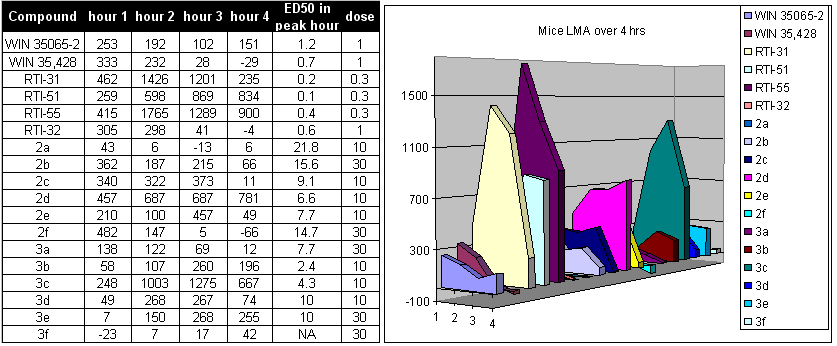
Все таблицы и графики, показанные ниже, взяты из статьи, опубликованной FIC, et al. 2004 г.[19] Таким образом, можно сделать следующие наблюдения: Тропарил, WIN35428 и RTI-32 недостаточно эффективны. Это наблюдение в основном основано на том факте, что при дозе 100 мг / кг и тропарил, и WIN35428 вызывают судороги. Изомеры типа «твист-лодка» во всех случаях недостаточно эффективны. В транс изомеры (альфа, бета) слишком слабы и могут быть опасны и вызывать смерть. RTI-55, хотя и обладает сильным действием, все же вызывает смерть в дозе 100 мг / кг. Рекомендуется учитывать РТИ-229. RTI-31 является наиболее мощным изомером DAT и был «безопасным» (в относительной шкале) даже в случае передозировки 100 мг / кг. РТИ-51 тоже выглядит «хорошим» соединением, хотя его синтез несколько сложнее, чем у РТИ-31. RTI-51 менее селективен для DAT, чем RTI-31, и также имеет заметное сродство с SERT.

Сродство связывания MAT
| RTI | Икс | [3H] CFT | [3H] Низоксетин | [3H] Пароксетин | N | S | N / D | S / D |
|---|---|---|---|---|---|---|---|---|
| — | ЧАС | 23 ± 5 | 920 ± 70 (550 ± 44) | 1960 ± 61 (178 ± 5.5) | 1.7 | 11 | 40 | 85.2 |
| — | F | 13.9 ± 2.0 | 835 ± 45 (503 ± 27) | 692 ± 27 (63 ± 2.5) | 1.7 | 11 | 60.1 | 49.8 |
| 31 | Cl | 1.1 ± 0.1 | 37 ± 2.1 (22 ± 1.3) | 44.5 ± 1.3 (4.0 ± 0.12) | 1.7 | 11 | 33.6 | 40.5 |
| 32 | Мне | 1.7 ± 0.3 | 60 ± 0.53 (36 ± 0.32) | 240 ± 27 (23 ± 2.5) | 1.7 | 10 | 35.3 | 141 |
| 51 | Br | 1.7 ± 0.2 | 37.4 ± 5.2 (23 ± 3.1) | 10.6 ± 0.24 (0.96 ± 0.02) | 1.6 | 11 | 22 | 6.24 |
| 55 | я | 1.3 ± 0.01 | 36 ± 2.7 (22 ± 1.6) | 4.21 ± 0.30 (0.38 ± 0.03) | 1.6 | 11 | 27.7 | 3.24 |
| 2а | ЧАС | 101 ± 16 | 541 ± 69 (271 ± 34) | 5700 ± 720 (518 ± 66) | 2.0 | 11 | 5.36 | 56.4 |
| 2b | F | 21.0 ± 0.5 | 1200 ± 90 (741 ± 55) | 5060 ± 490 (460 ± 44) | 1.6 | 11 | 57.1 | 241 |
| 2c | Cl | 3.1 ± 0.6 | 5.14 ± 1.08 (3.1 ± 0.60) | 53 ± 3 (4.8 ± 0.26) | 1.7 | 11 | 1.66 | 17.1 |
| 2f | Мне | 10.2 ± 0.8 | 270 ± 24 (160 ± 14) | 4250 ± 420 (390 ± 38) | 1.7 | 11 | 26.5 | 417 |
| 549 | Br | 1.7 ± 0.4 | 32.4 ± 3.5 (16.2 ± 1.7) | 84 ± 13.5 (20.6 ± 3.3) | 2.0 | 4.1 | 19.1 | 49.4 |
| 352 | я | 2.9 ± 0.2 | 52.4 ± 4.9 (32 ± 2.0) | 64.9 ± 1.97 (5.9 ± 0.18) | 1.6 | 11 | 18.1 | 22.4 |
| 3а | ЧАС | 670 ± 90 | >10000 | >10000 | — | |||
| 3b | F | 325 ± 8 | 7200 ± 810 (4340 ± 480) | >10000 | 1.7 | — | ||
| 3c | Cl | 25.0 ± 5 | 444 ± 29 (222 ± 15) | 1450 ± 160 (356 ± 40) | 2.0 | 4.1 | 17.8 | 58.0 |
| 3f | Мне | 207 ± 21 | 2230 ± 380 (1120 ± 190) | >10000 | 2.0 | — | ||
| 3D | Br | 15.7 ± 0.9 | 272 ± 25 (136 ± 15) | 570 ± 80 (140 ± 20) | 2.0 | 4.1 | 17.3 | 36.3 |
| 3e | я | 22.7 ± 0.9 | 760 ± 49 (458 ± 30) | 66.3 ± 1.8 (6.0 ± 0.16) | 1.7 | 11 | 33.5 | 2.92 |
LMA, D.D. и Г.

Родственные соединения
Близкородственные соединения имеют различные арил фрагмент, как нафтил, или разнообразный тропановый фрагмент, например, с замененным гетероатом, троп-2-ены, хинуклидины, пиперидины.
Рекомендации
- ^ "Метил должен быть у другого О, и транс"не помещает метильную группу где-то еще в молекуле: сложноэфирная группа ориентирована больше наружу, что приводит к меньшему скоплению вокруг метильной группы. Вторым преимуществом этой ориентации является освобождение атома азота для образования водородной связи или даже для принятия протона чтобы сформировать лучше растворимый положительно заряженный ион.
- ^ а б Кэрролл, Ф. (2003). «Награда Отделения медицинской химии 2002 года: переносчики моноаминов и опиоидные рецепторы. Мишени для лечения зависимости». Журнал медицинской химии. 46 (10): 1775–1794. Дои:10.1021 / jm030092d. PMID 12723940.
- ^ а б Runyon, S.P .; Кэрролл, Ф. И. (2006). «Лиганды переносчика дофамина: последние разработки и терапевтический потенциал». Актуальные темы медицинской химии. 6 (17): 1825–1843. Дои:10.2174/156802606778249775. ISSN 1568-0266. PMID 17017960.
- ^ Патент США 3813404, CLARKE R & DAUM S., "ТРОПАН-2-КАРБОКСИЛАТЫ И ПРОИЗВОДНЫЕ", опубликовано 28 мая 1974 г.
- ^ Clarke, R.L .; Daum, S.J .; Гамбино, А. Дж .; Aceto, M.D .; Pearl, J .; Levitt, M .; Cumiskey, W. R .; Богадо, Э. Ф. (1973). «Соединения, влияющие на центральную нервную систему. 4. 3 Бета-фенилтропан-2-сложные эфиры и аналоги». Журнал медицинской химии. 16 (11): 1260–1267. Дои:10.1021 / jm00269a600. PMID 4747968.
- ^ Ritz, M.C .; Кухар, М. Дж. (1993). «Психостимуляторы и допаминовая гипотеза о зависимости: обновленная информация о последних исследованиях». Симпозиум Биохимического общества. 59: 51–64. PMID 7910741.
- ^ Zhu, J .; Райт, М. Э. (2008). «Роль переносчика дофамина в действии психостимуляторов, никотина и других наркотиков». Мишени для лекарств от ЦНС и неврологических расстройств. 7 (5): 393–409. Дои:10.2174/187152708786927877. ЧВК 3133725. PMID 19128199.
- ^ Повар, C .; Кэрролл, I .; Бердсли, П. (2001). «Кокаиноподобные дискриминационные стимулирующие эффекты нового кокаина и аналогов 3-фенилтропана у крыс». Психофармакология. 159 (1): 58–63. Дои:10.1007 / s002130100891. PMID 11797070.
- ^ Czoty, P.W .; Гинзбург, Британская Колумбия; Хауэлл, Л.Л. (2002). «Серотонинергическое ослабление усиливающих и нейрохимических эффектов кокаина у беличьих обезьян» (PDF). Журнал фармакологии и экспериментальной терапии. 300 (3): 831–7. Дои:10.1124 / jpet.300.3.831. Архивировано из оригинал (PDF) 21 сентября 2006 г.
- ^ Negus, S .; Mello, N .; Kimmel, H .; Howell, L .; Кэрролл, Ф. (2009). «Влияние ингибиторов захвата моноаминов RTI-112 и RTI-113 на кокаин и пищу, поддерживаемую ответами у макак-резусов». Фармакология, биохимия и поведение. 91 (3): 333–338. Дои:10.1016 / j.pbb.2008.08.002. ЧВК 2645592. PMID 18755212.
- ^ Howell, L .; Кэрролл, Ф .; Votaw, J .; Goodman, M .; Киммел, Х. (2007). «Эффекты комбинированных ингибиторов переносчика дофамина и серотонина на самовведение кокаина у макак-резусов». Журнал фармакологии и экспериментальной терапии. 320 (2): 757–765. Дои:10.1124 / jpet.106.108324. PMID 17105829.
- ^ Хауэлл, Л. (2008). «Разработка нейровизуализации нечеловеческих приматов и кокаиновых препаратов». Экспериментальная и клиническая психофармакология. 16 (6): 446–457. Дои:10.1037 / a0014196. ЧВК 3228245. PMID 19086766.
- ^ Phillips, K .; Luk, A .; Соор, Г .; Abraham, J .; Leong, S .; Бутани, Дж. (2009). «Кардиотоксичность кокаина: обзор патофизиологии, патологии и вариантов лечения». Американский журнал сердечно-сосудистых препаратов. 9 (3): 177–196. Дои:10.1007 / bf03256574. PMID 19463023.
- ^ а б Кэрролл, Ф .; Howard, J .; Howell, L .; Fox, B .; Кухар, М. (2006). «Разработка селективного переносчика дофамина RTI-336 в качестве фармакотерапии при злоупотреблении кокаином». Журнал AAPS. 8 (1): E196 – E203. Дои:10.1208 / aapsj080124. ЧВК 2751440. PMID 16584128.
- ^ Доус, Л. (2009). «Неверные переносчики нейромедиаторов: акцент на поглощении серотонина и последствиях для эффективности антидепрессантов». Фармакология и терапия. 121 (1): 89–99. Дои:10.1016 / j.pharmthera.2008.10.004. ЧВК 2739988. PMID 19022290.
- ^ Мадрас, Б. К .; Fahey, M. A .; Goulet, M .; Lin, Z .; Бендор, Дж .; Goodrich, C .; Meltzer, P.C .; Elmaleh, D. R .; Livni, E .; Bonab, A .; Фишман, А. Дж. (2006). «Ингибиторы переносчика дофамина (DAT) облегчают специфический паркинсонический дефицит у обезьян: связь с занятостью DAT in vivo». Журнал фармакологии и экспериментальной терапии. 319 (2): 570–585. Дои:10.1124 / jpet.106.105312. PMID 16885433.
- ^ Кэрролл, Ф .; Тяги, С .; Blough, B .; Кухар, М .; Наварро, Х. (2005). «Синтез и свойства связывания переносчика моноаминов метиловых эфиров 3альфа- (замещенного фенил) нортропан-2бета-карбоновой кислоты. Селективные соединения переносчика норэпинефрина». Журнал медицинской химии. 48 (11): 3852–3857. Дои:10.1021 / jm058164j. PMID 15916437.
- ^ Blough, B .; Abraham, P .; Lewin, A .; Кухар, М .; Boja, J .; Кэрролл, Ф. (1996). «Синтез и свойства связывания переносчика метиловых эфиров 3β- (4′-алкил-, 4′-алкенил и 4′-алкинилфенил) нортропан-2β-карбоновой кислоты: селективные аналоги переносчика серотонина». Журнал медицинской химии. 39 (20): 4027–4035. Дои:10.1021 / jm960409s. PMID 8831768.
- ^ Carroll, F. I .; Runyon, S.P .; Abraham, P .; Navarro, H .; Кухар, М. Дж .; Pollard, G.T .; Ховард, Дж. Л. (2004). «Связывание переносчика моноаминов, двигательная активность и свойства различения лекарственных средств изомеров метилового эфира 3- (4-замещенного фенил) тропан-2-карбоновой кислоты». Журнал медицинской химии. 47 (25): 6401–6409. Дои:10.1021 / jm0401311. PMID 15566309.
- ^ Wee, S .; Кэрролл, Ф .; Вулвертон, В. (2006). «Сниженная скорость связывания переносчика дофамина in vivo связана с более низкой относительной усиливающей эффективностью стимуляторов». Нейропсихофармакология. 31 (2): 351–362. Дои:10.1038 / sj.npp.1300795. PMID 15957006.
- ^ Kimmel, H. .; О'Коннор, Дж .; Кэрролл, Ф. .; Хауэлл, Л. (2007). «Более быстрое начало действия и селективность переносчика дофамина позволяют прогнозировать стимулирующие и усиливающие эффекты аналогов кокаина у беличьих обезьян». Фармакология, биохимия и поведение. 86 (1): 45–54. Дои:10.1016 / j.pbb.2006.12.006. ЧВК 1850383. PMID 17258302.

