Арилциклогексиламин - Arylcyclohexylamine
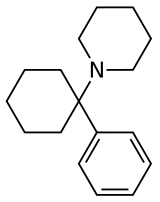
Арилциклогексиламины, также известен как арилциклогексамины или арилциклогексанамины, площадь химический класс из фармацевтический, дизайнер, и экспериментальные препараты.
История
Фенциклидин (PCP) считается первым арилциклогексиламином с признанными анестезирующими свойствами, но несколько арилциклогексиламинов были описаны в научной литературе до PCP, начиная с PCA (1-фенилциклогексан-1-амин), синтез которого был впервые опубликован в 1907 году. PCE было сообщено в 1953 году и PCMo в 1954 году, причем последнее соединение было описано как сильнодействующее седативное средство.[1] Анестетики на основе арилциклогексиламина интенсивно исследовались в Парк-Дэвис, начиная с синтеза 1956 г. фенциклидин а позже родственное соединение кетамин.[1] В 1970-х годах дебютировали эти соединения, особенно PCP и его аналоги, как незаконно использованный рекреационные наркотики из-за их диссоциативный галлюциногенный и эйфорический эффекты. С тех пор класс был расширен на научное исследование в стимулятор, обезболивающее, и нейропротекторный агентами, а также тайный химики в поисках романа рекреационные наркотики.[2][3][4]
Структура

Арилциклогексиламин состоит из циклогексиламин блок с арил часть привязанность. Арильная группа расположена близнец к амин. В простейших случаях арильный фрагмент обычно представляет собой фенильное кольцо, иногда с дополнительной заменой. Амин обычно не первичный; вторичные амины, такие как метиламино или этиламино, или третичные циклоалкиламины, такие как пиперидино и пирролидино, являются наиболее часто встречающимися N-замещающие.
Фармакология
Арилциклогексиламины в различной степени обладают Антагонист рецептора NMDA,[5][6] ингибитор обратного захвата дофамина,[7] и μ-опиоидный рецептор агонистический[8] свойства. Дополнительно, рецептор σ агонистический,[9] рецептор nACh антагонистический,[10] и D2 рецептор агонистический[11] поступили сообщения о действиях некоторых из этих агентов. Антагонизм рецептора NMDA оказывает анестезирующее, противосудорожное, нейрозащитное и диссоциативное действие; блокада переносчик дофамина оказывает стимулирующее и эйфориантное действие, а также психоз в больших количествах; и активация μ-опиоидного рецептора вызывает обезболивающий и эйфориантный эффекты. Стимуляция σ и D2 рецепторы также могут способствовать галлюциногенным и психотомиметическим эффектам.[11]
Это универсальные агенты с широким диапазоном возможных фармакологических активностей в зависимости от степени и диапазона, в котором применяются химические модификации.[12][13][14][15][16][17][18][19][20] Разнообразный выбор производимых замен позволяет «отрегулировать» получаемый фармакологический профиль. В качестве примеров BTCP выборочный ингибитор обратного захвата дофамина,[7] PCP в первую очередь является антагонистом NMDA,[5] и BDPC является сильным агонистом μ-опиоидов,[21] в то время как PRE-084 выборочный сигма рецептор агонист.[22] Таким образом, радикально отличная фармакология возможна благодаря различным структурным комбинациям.
Список арилциклогексиламинов
| Структура | Соединение | Арильный заместитель | Группа N | Циклогексильное кольцо |
|---|---|---|---|---|
 | PCA[23] | Фенил | NH2 | - |
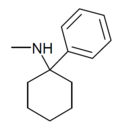 | PCM[23] | Фенил | Метиламино | - |
 | Этициклидин | Фенил | Этиламино | - |
 | PCPr [24] | Фенил | п-Пропиламино | - |
 | PCiP | Фенил | Изопропиламино | - |
 | PCAL [25] | Фенил | Аллиламино | - |
 | PCBu | Фенил | п-Бутиламино | - |
 | PCEOH | Фенил | Гидроксиэтиламино | - |
 | PCMEA[26] | Фенил | Метоксиэтиламино | - |
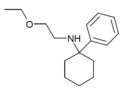 | PCEEA | Фенил | Этоксиэтиламино | - |
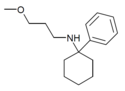 | PCMPA | Фенил | Метоксипропиламино | - |
 | PCDM[23] | Фенил | Диметиламино | - |
 | Диетциклидин | Фенил | Диэтиламино | - |
 | 2-HO-PCP[5] | Фенил | Пиперидин | 2-гидрокси |
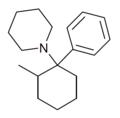 | 2-Me-PCP[27] | Фенил | Пиперидин | 2-метил |
 | 2-MeO-PCP[28] | Фенил | Пиперидин | 2-метокси |
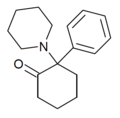 | 2-кето-PCP | Фенил | Пиперидин | 2-Кето |
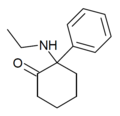 | Этициклидон ("O-PCE") | Фенил | Этиламино | 2-Кето |
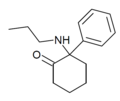 | 2-кето-PCPr | Фенил | п-Пропиламино | 2-Кето |
 | 4-метил-PCP | Фенил | Пиперидин | 4-метил |
 | 4-кето-PCP | Фенил | Пиперидин | 4-кето |
 | 2'-Cl-PCP | о-Хлорфенил | Пиперидин | - |
 | 3'-Cl-PCP | м-Хлорфенил | Пиперидин | - |
 | 2'-MeO-PCP | о-Метоксифенил | Пиперидин | - |
 | 3'-F-PCP[29] | м-Фторфенил | Пиперидин | - |
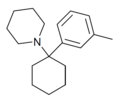 | 3'-Me-PCP[30] | м-Толил | Пиперидин | - |
 | 3'-Me-PCPy | м-Толил | Пирролидин | - |
 | 3'-NH2-PCP | м-Аминофенил | Пиперидин | - |
 | 3'-HO-PCP | м-Гидроксифенил | Пиперидин | - |
 | 3'-MeO-PCP | м-Метоксифенил | Пиперидин | - |
 | 3 ', 4'-МД-ПКП | 3,4-метилендиоксифенил | Пиперидин | - |
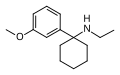 | 3'-MeO-PCE | м-Метоксифенил | Этиламино | - |
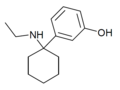 | 3'-HO-PCE | м-Гидроксифенил | Этиламино | - |
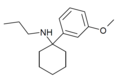 | 3'-MeO-PCPr | м-Метоксифенил | п-Пропиламино | - |
 | 3'-HO-PCPr | м-Гидроксифенил | п-Пропиламино | - |
 | 3 ', 4'-МД-ПКПр | 3,4-метилендиоксифенил | п-Пропиламино | - |
 | 3'-MeO-PCPy[30] | м-Метоксифенил | Пирролидин | - |
 | 4'-HO-PCP | п-Гидроксифенил | Пиперидин | - |
 | Метоксидин (4'-MeO-PCP) | п-Метоксифенил | Пиперидин | - |
 | 4'-MeO-PCE | п-Метоксифенил | Этиламино | - |
 | 4'-F-PCP[29] | п-Фторфенил | Пиперидин | - |
 | 4'-F-PCPy | п-Фторфенил | Пирролидин | - |
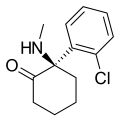 | Аркетамин | о-Хлорфенил | Метиламино | 2-Кето |
 | Десхлорокетамин | Фенил | Метиламино | 2-Кето |
 | Эскетамин | о-Хлорфенил | Метиламино | 2-Кето |
 | Кетамин | о-Хлорфенил | Метиламино | 2-Кето |
 | Гидроксиноркетамин | о-Хлорфенил | NH2 | 2-кето, 6-гидрокси |
 | Эткетамин | о-Хлорфенил | Этиламино | 2-Кето |
 | NPNK | о-Хлорфенил | п-Пропиламино | 2-Кето |
 | Метоксикетамин | о-Метоксифенил | Метиламино | 2-Кето |
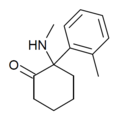 | oMDCK | о-Толил | Метиламино | 2-Кето |
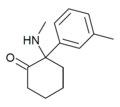 | mMDCK | м-Толил | Метиламино | 2-Кето |
 | мета-Кетамин | м-Хлорфенил | Метиламино | 2-Кето |
 | iso-Кетамин | о-Хлорфенил | Метиламино | 4-кето |
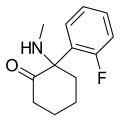 | 2-фтордесхлоркетамин | о-Фторфенил | Метиламино | 2-Кето |
 | 3-фтордесхлоркетамин | м-Фторфенил | Метиламино | 2-Кето |
 | Бромокетамин | о-Бромфенил | Метиламино | 2-Кето |
 | TFMDCK | о-Трифторметилфенил | Метиламино | 2-Кето |
 | SN 35210 [31] | о-Хлорфенил | Карбометоксибутиламино | 2-Кето |
 | Метоксетамин | м-Метоксифенил | Этиламино | 2-Кето |
 | Метоксметамин | м-Метоксифенил | Метиламино | 2-Кето |
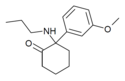 | Метокспропамин | м-Метоксифенил | п-Пропиламино | 2-Кето |
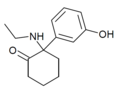 | HXE | м-Гидроксифенил | Этиламино | 2-Кето |
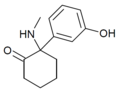 | HXM | м-Гидроксифенил | Метиламино | 2-Кето |
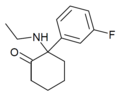 | FXE | м-Фторфенил | Этиламино | 2-Кето |
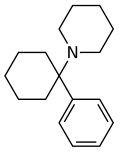 | Фенциклидин (PCP) | Фенил | Пиперидин | - |
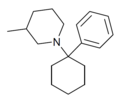 | PC3MP | Фенил | 3-метилпиперидин | - |
 | PC4MP | Фенил | 4-метилпиперидин | - |
 | Ролициклидин (PCPy) | Фенил | Пирролидин | - |
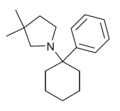 | PCDMPy | Фенил | 3,3-диметилпирролидин | - |
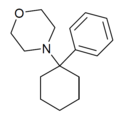 | PCMo | Фенил | Морфолин | - |
 | Метокси-ПКМ[6] (2'-MeO-PCMo) | о-Метоксифенил | Морфолин | - |
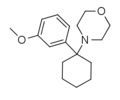 | 3'-MeO-PCMo | м-Метоксифенил | Морфолин | - |
 | 4'-MeO-PCMo | п-Метоксифенил | Морфолин | - |
 | Метил-ПКМ[32] (4'-Me-PCMo) | п-Толил | Морфолин | - |
 | Гидроксиметил-ПКМ | 2-метил-4-гидроксифенил | Морфолин | - |
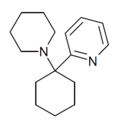 | PYCP [33] | 2-пиридинил | Пиперидин | - |
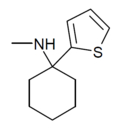 | TCM | 2-тиенил | Метиламино | - |
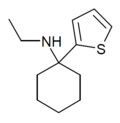 | ТВК | 2-тиенил | Этиламино | - |
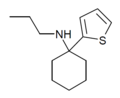 | TCPr [34] | 2-тиенил | Пропиламино | - |
 | Теноциклидин (TCP) | 2-тиенил | Пиперидин | - |
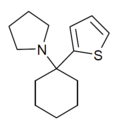 | TCPy | 2-тиенил | Пирролидин | - |
 | Тилетамин | 2-тиенил | Этиламино | 2-Кето |
 | Гациклидин | 2-тиенил | Пиперидин | 2-метил |
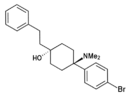 | BDPC | п-Бромфенил | Диметиламино | 4-фенэтил-4-гидрокси |
 | С-8813 | п-Бромфенил | Диметиламино | 4- (тиофен-2-ил) этил-4-гидрокси |
 | Диметамин [35] | п-Толил | Диметиламино | 4-кето |
 | 3 '' - OH-2'-Me-PCP [36] | о-Толил | 3-гидроксипиперидин | - |
 | 4 '' - Ph-4 '' - OH-PCP [37] | Фенил | 4-фенил-4-гидроксипиперидин | - |
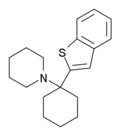 | BTCP[38] | Бензотиофен-2-ил | Пиперидин | - |
 | BTCPy[39] | Бензотиофен-2-ил | Пирролидин | - |
 | PRE-084 | Фенил | Морфолинилэтилкарбоксилат | - |
Были проведены эксперименты с другими размерами циклоалкановых колец, а не только с точки зрения циклогексиламина. Циклопентильный гомолог PCP активен примерно с 1/10 активности, в то время как циклогептильные и циклооктильные производные неактивны. Необходимый циклоалкилкетон реагирует с PhMgBr; 3 ° спирт затем реагирует с NaN3; азид затем восстанавливается с помощью LAH. Затем на последней стадии пиперидиновое кольцо конструируется из 1-5-дибромпентана.[40]
Жесткий
Конформационно ограниченный аналоги были также получены и исследованы Morieti et al.[41]
использованная литература
- ^ а б Morris, H .; Валлах, Дж. (2014). «От PCP к MXE: всесторонний обзор немедицинского использования диссоциативных препаратов». Тестирование и анализ на наркотики. 6 (7–8): 614–32. Дои:10.1002 / dta.1620. PMID 24678061.
- ^ Валтер К., Аррисабалага П. Каталог дизайнерских препаратов. Эльзевир, 1998. ISBN 0-444-20525-X
- ^ Уоллах Дж., Брандт С.Д. (август 2018 г.). «Новые психоактивные вещества на основе фенциклидина». Новые психоактивные вещества. Справочник по экспериментальной фармакологии. 252. С. 261–303. Дои:10.1007/164_2018_124. ISBN 978-3-030-10560-0. PMID 30105474.
- ^ Уоллах, Джейсон; Брандт, Саймон Д. (2018). «Новые психоактивные вещества на основе 1,2-диарилэтиламина и кетамина». Новые психоактивные вещества. Справочник по экспериментальной фармакологии. 252. С. 305–352. Дои:10.1007/164_2018_148. ISBN 978-3-030-10560-0. PMID 30196446.
- ^ а б c Ахмади, А .; Махмуди, А. (2005). «Синтез и биологические свойства 2-гидрокси-1- (1-фенилтетралил) пиперидина и некоторых его промежуточных соединений как производных фенциклидина». Arzneimittel-Forschung. 55 (9): 528–532. Дои:10.1055 / с-0031-1296900. PMID 16229117.
- ^ а б Ахмади, А .; Халили, М .; Гаджихани, Р .; Насербахт, М. (2011). «Новые морфолиновые аналоги фенциклидина: химический синтез и восприятие боли у крыс». Фармакология, биохимия и поведение. 98 (2): 227–233. Дои:10.1016 / j.pbb.2010.12.019. PMID 21215770.
- ^ а б Chaudieu, I .; Виньон; Чичепортиче; Каменка; Trouiller; Чичепортиче (1989). «Роль ароматической группы в ингибировании связывания фенциклидина и захвата дофамина аналогами PCP». Фармакология, биохимия и поведение. 32 (3): 699–705. Дои:10.1016/0091-3057(89)90020-8. PMID 2544905.
- ^ Itzhak, Y .; Саймон (1984). «Новый аналог фенциклидина избирательно взаимодействует с мю-опиоидными рецепторами». Журнал фармакологии и экспериментальной терапии. 230 (2): 383–386. PMID 6086884.
- ^ Он, X. S .; Raymon, L.P .; Mattson, M. V .; Eldefrawi, M.E .; Де Коста, Б. Р. (1993). «Синтез и биологическая оценка гомологов 1-1- (2-бензобтиенил) циклогексилпиперидина на сайтах связывания дофамина и фенциклидин- и сигма-связывания». Журнал медицинской химии. 36 (9): 1188–1193. Дои:10.1021 / jm00061a009. PMID 8098066.
- ^ Этерович, В. А .; Lu, R .; Eakin, A.E .; Rodríguez, A.D .; Ферчмин П.А. (1999). «Детерминанты активности фенциклидина на никотиновые рецепторы ацетилхолина из мышц и электрических органов». Клеточная и молекулярная нейробиология. 19 (6): 745–757. Дои:10.1023 / А: 1006905106834. PMID 10456235.
- ^ а б Seeman, P .; Ko, F .; Таллерико, Т. (2005). «Вклад дофаминовых рецепторов в действие психотомиметиков PCP, LSD и кетамина». Молекулярная психиатрия. 10 (9): 877–883. Дои:10.1038 / sj.mp.4001682. PMID 15852061.
- ^ аль-Диб, О.А. (май 1996 г.). «Новые анальгетики на основе аналога фенциклидина тиенилциклидина». Arzneimittelforschung. 46 (5): 505–8. PMID 8737636.
- ^ Ахмади, А; Халили, М; Гаджихани, Р; Хоссейни, H; Афшин, Н; Нахри-Никнафс, Б. (2012). «Синтез и изучение анальгетических эффектов новых аналогов кетамина на самках крыс линии Вистар». Медицинская химия. 8 (2): 246–51. Дои:10.2174/157340612800493683. PMID 22385170. S2CID 42842315.
- ^ Ахмади, А; Халили, М; Abbassi, S; Джавади, М. Махмуди, А; Гаджихани, Р. (2009). «Синтез и исследование анальгетических эффектов 1-1- (4-метилфенил) (циклогексил) 4-пиперидинола и 1-1- (4-метоксифенил) (циклогексил) 4-пиперидинола как двух новых производных фенциклидина». Arzneimittel-Forschung. 59 (4): 202–6. Дои:10.1055 / с-0031-1296386. PMID 19517897. S2CID 5402425.
- ^ Ахмади, А; Халили, М; Марами, S; Гадири, А; Нари-Никнафс, Б. (2014). «Синтез и восприятие боли новых аналогов фенциклидина у мышей-самцов NMRI». Мини-обзоры по медицинской химии. 14 (1): 64–71. Дои:10.2174/1389557513666131119203551. PMID 24251803.
- ^ Ахмади, А; Солати, Дж; Гаджихани, Р; Пакзад, S (2011). «Синтез и обезболивающие эффекты новых пиррольных производных фенциклидина у мышей». Arzneimittel-Forschung. 61 (5): 296–300. Дои:10.1055 / с-0031-1296202. PMID 21755813. S2CID 24287727.
- ^ Ахмади, А; Халили; Гаджихани; Барги; Михандуст (2010). «Синтез и определение активности хронической и острой термической и химической боли нового производного фенциклидина у крыс». Иранский журнал фармацевтических исследований. 9 (4): 379–85. ЧВК 3870061. PMID 24381602.
- ^ Ахмади, А; Халили, М; Михандуст, Ф; Барги, Л. (2010). «Синтез и определение активности острой и хронической боли 1-1- (3-метилфенил) (тетралил) пиперидина как нового производного фенциклидина с помощью иммерсии хвоста и формалиновых тестов». Arzneimittel-Forschung. 60 (1): 30–5. Дои:10.1055 / с-0031-1296245. PMID 20184224. S2CID 23966936.
- ^ Гаджихани, Р; Ахмади, А; Надери, N; Yaghoobi, K; Ширазизанд, З; Rezaee, N.M .; Никнафс, Б. Н. (2012). «Влияние производных фенциклидина на тревожное поведение с использованием теста приподнятого крестообразного лабиринта на мышах». Достижения клинической и экспериментальной медицины. 21 (3): 307–12. PMID 23214193.
- ^ Ахмади, А; Халили, М; Мирза, Б; Mohammadi-Diz, M; Азами-Лорестани, Ф; Ghaderi, P; Нари-Никнафс, Б. (2017). «Синтез и антиноцицепционная активность некоторых новых производных фенциклидина с замещенными аминобензотиазолами». Мини Rev Med Chem. 17 (1): 78–84. Дои:10.2174/1389557516666160428112532. PMID 27121715.
- ^ Lednicer, D .; Вонвойгтландер, П. Ф. (1979). «4- (п-Бромфенил) -4- (диметиламино) -1-фенэтилциклогексанол, чрезвычайно мощный представитель новой серии анальгетиков». Журнал медицинской химии. 22 (10): 1157–1158. Дои:10.1021 / jm00196a001. PMID 513062.
- ^ Морис, Т .; Su, T. P .; Parish, D. W .; Набешима, Т .; Приват, А. (1994). «PRE-084, сигма-селективное производное PCP, ослабляет вызванное MK-801 нарушение обучения у мышей». Фармакология, биохимия и поведение. 49 (4): 859–869. Дои:10.1016/0091-3057(94)90235-6. PMID 7886099.
- ^ а б c Thurkauf, A .; De Costa, B .; Yamaguchi, S .; Mattson, M. V .; Jacobson, A.E .; Райс, К. С .; Рогавский, М.А. (1990). «Синтез и противосудорожная активность аналогов 1-фенилциклогексиламина». Журнал медицинской химии. 33 (5): 1452–8. Дои:10.1021 / jm00167a027. PMID 2329567.
- ^ Sauer, C .; Peters, F .; Staack, R .; Fritschi, G .; Маурер, Х. (2008). «Метаболизм и токсикологическое обнаружение нового дизайнерского препарата, N- (1-фенилциклогексил) пропанамина, в моче крысы с использованием газовой хроматографии-масс-спектрометрии». Журнал хроматографии А. 1186 (1–2): 380–390. Дои:10.1016 / j.chroma.2007.11.002. PMID 18035363.
- ^ Калир, А; Теомы, S; Амир, А; Fuchs, P; Ли, С.А.; Holsztynska, EJ; Роки, Вт; Домино, EF (октябрь 1984 г.). «N-аллильные аналоги фенциклидина: химический синтез и фармакологические свойства». J Med Chem. 27 (10): 1267–71. Дои:10.1021 / jm00376a006. PMID 6481761.
- ^ Sauer, C .; Peters, F .; Schwaninger, A .; Мейер, М .; Маурер, Х. (2009). «Исследования изоферментов цитохрома P450 (CYP), участвующих в метаболизме дизайнерских наркотиков N- (1-фенилциклогексил) -2-этоксиэтанамина и N- (1-фенилциклогексил) -2-метоксиэтанамина». Биохимическая фармакология. 77 (3): 444–450. Дои:10.1016 / j.bcp.2008.10.024. PMID 19022226.
- ^ Иорио, М. А .; Tomassini, L .; Mattson, M. V .; Джордж, С .; Якобсон, А. Э. (1991). «Синтез, стереохимия и биологическая активность 1- (1-фенил-2-метилциклогексил) пиперидинов и 1- (1-фенил-4-метилциклогексил) пиперидинов. Абсолютная конфигурация сильнодействующих транс - (-) - 1- (1-фенил-2-метилциклогексил) пиперидин ». Журнал медицинской химии. 34 (8): 2615–2623. Дои:10.1021 / jm00112a041. PMID 1875352.
- ^ Ахмади, А .; Махмуди, А. (2006). «Синтез с улучшенным выходом и исследование анальгетического эффекта 2-метоксифенциклидина». Arzneimittel-Forschung. 56 (5): 346–350. Дои:10.1055 / с-0031-1296732. PMID 16821645.
- ^ а б Огунбадений, А. М .; Адехаре, А. (2002). «Синтезы фторированных аналогов фенциклидина». Журнал химии фтора. 114: 39–42. Дои:10.1016 / S0022-1139 (01) 00565-6.
- ^ а б Wallach, J .; Paoli, G.D .; Adejare, A .; Брандт, С. Д. (2013). «Получение и аналитическая характеристика аналогов 1- (1-фенилциклогексил) пиперидина (PCP) и 1- (1-фенилциклогексил) пирролидина (PCPy)». Тестирование и анализ на наркотики. 6 (7–8): 633–50. Дои:10.1002 / dta.1468. PMID 23554350.
- ^ Харви, М; Сани, Дж; Voss, L; Pruijn, F; Jose, J; Gamage, S; Денни, W (2015). "Определение гипнотической активности нового аналога сложного эфира кетамина SN 35210 у крыс". Фармакология. 96 (5–6): 226–32. Дои:10.1159/000439598. PMID 26352278.
- ^ Ахмади А., Халили М., Гаджихани Р., Насербахт М. (2011). «Синтез и определение активности острой и хронической боли 1- [1- (4-метилфенил) (циклогексил)] морфолина как нового производного фенциклидина у крыс». Arzneimittel-Forschung. 61 (2): 92–7. Дои:10.1055 / с-0031-1296173. PMID 21428243.
- ^ Zarantonello, P; Bettini, E; Пайо, А; Simoncelli, C; Террени, S; Кардулло, Ф (апрель 2011 г.). «Новые аналоги кетамина и фенциклидина как антагонисты рецепторов NMDA». Биоорг Мед Хем Летт. 21 (7): 2059–63. Дои:10.1016 / j.bmcl.2011.02.009. PMID 21334205.
- ^ Валлах, Дж; Колсток, Т; Cicali, B; Elliott, SP; Кавана, П.В. Адехаре, А; Демпстер, Нью-Мексико; Брандт, SD (2016). «Синтезы и аналитические характеристики N-алкил-арилциклогексиламинов» (PDF). Анальный тест на наркотики. 8 (8): 801–815. Дои:10.1002 / dta.1861. PMID 26360516.
- ^ Lednicer, D; VonVoigtlander, PF; Emmert, DE (апрель 1980 г.). «4-Амино-4-арилциклогексаноны и их производные, новый класс анальгетиков. 1. Модификация арильного кольца». J Med Chem. 23 (4): 424–30. Дои:10.1021 / jm00178a014. PMID 7381841.
- ^ Ахмади, А; Солати, Дж; Гаджихани, Р; Онаг, М; Джавади, М. (2010). «Синтез и обезболивающие эффекты 1-1- (2-метилфенил) (циклогексил) -3-пиперидинола как нового производного фенциклидина у мышей». Arzneimittel-Forschung. 60 (8): 492–6. Дои:10.1055 / с-0031-1296317. PMID 20863005. S2CID 24803623.
- ^ Ицхак, Y; Калир, А; Weissman, BA; Коэн, S (1981). «Новые обезболивающие на основе фенциклидина». J Med Chem. 24 (5): 496–9. Дои:10.1021 / jm00137a004. PMID 7241506.
- ^ Vignon, J .; Pinet, V .; Cerruti, C .; Каменка, Ж. М .; Chicheportiche, R. (1988). «3HN-1- (2-бензо (b) тиофенил) циклогексилпиперидин (3HBTCP): новый аналог фенциклидина, селективный для комплекса захвата дофамина». Европейский журнал фармакологии. 148 (3): 427–436. Дои:10.1016/0014-2999(88)90122-7. PMID 3384005.
- ^ Он, XS; Раймон, LP; Маттсон, М.В.; Эльдефрави, Мэн; de Costa, BR (апрель 1993 г.). «Синтез и биологическая оценка гомологов 1- [1- (2-бензо [b] тиенил) циклогексил] пиперидина на сайтах связывания дофамина и фенциклидина и сигма». J Med Chem. 36 (9): 1188–93. Дои:10.1021 / jm00061a009. PMID 8098066.
- ^ Маккуинн, Рой Л. (1981). «Соотношение структура-активность циклоалкильного кольца фенциклидина». Журнал медицинской химии. 24 (12): 1429–1432. Дои:10.1021 / jm00144a011. PMID 7310819.
- ^ Moriarty, R .; Enache, L .; Zhao, L .; Gilardi, R .; Mattson, M .; Пракаш О. (1998). «Жесткие аналоги фенциклидина. Связывание с рецепторами фенциклидина и сигма-1». Журнал медицинской химии. 41 (4): 468–477. Дои:10.1021 / jm970059p. PMID 9484497.
внешние ссылки
- Моррис, H; Уоллах, Дж (2014). «От PCP к MXE: всесторонний обзор немедицинского использования диссоциативных препаратов». Анальный тест на наркотики. 6 (7–8): 614–32. Дои:10.1002 / dta.1620. PMID 24678061.
- Синтез и эффекты аналогов ПХФ
- Интервью с химиком по кетамину
