Таметралин - Википедия - Tametraline
 | |
| Клинические данные | |
|---|---|
| Код УВД |
|
| Идентификаторы | |
| |
| Количество CAS | |
| PubChem CID | |
| ChemSpider | |
| UNII | |
| Панель управления CompTox (EPA) | |
| Химические и физические данные | |
| Формула | C17ЧАС19N |
| Молярная масса | 237.346 г · моль−1 |
| 3D модель (JSmol ) | |
| |
| |
| | |
Таметралин (CP-24,441) является родителем ряда химических соединений, исследованных в Pfizer что в конечном итоге привело к развитию сертралин (CP-51,974-1).[1]
Сертралин был назван «3,4-дихлор-таметралин». Это правильно, но это чрезмерное упрощение в том смысле, что сертралин - это S,S-изомер, тогда как таметралин является 1р,4S-стереоизомер.
1р-Метиламино-4S-фенил-тетралин является мощным ингибитором захвата норадреналина синаптосомами головного мозга крыс,[2] переворачивает Резерпин вызывает переохлаждение у мышей и блокирует усвоение 3ЧАС -Норэпинефрин в сердце крысы.[3]
Таметралин - это ингибитор обратного захвата норэпинефрина-дофамина.[4]
Индатралин является инданаминовым гомологом таметралина на основе тетралина, хотя в случае индатралина продукт является pm-дихлорированным.
Химия
Ранее были описаны два маршрута:[5] один для арил фрагменты, содержащие электроноакцепторные группы, и один для электронодонорных групп:

"Как и ожидалось, Friedel-Crafts циклизация производных диарилмасляной кислоты до наиболее реакционноспособного кольца наблюдали при небольшом обнаружении альтернативного изомера или его отсутствии ».
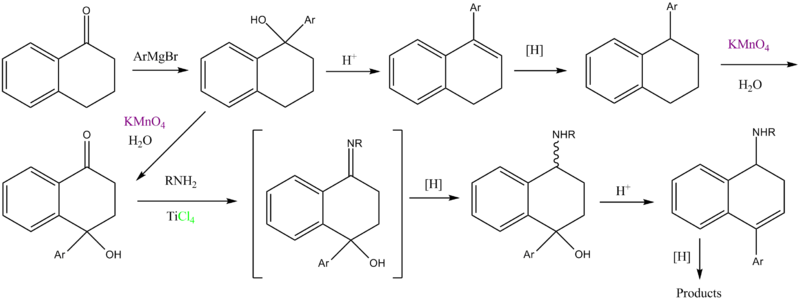
"The KMnO4 окисление 1-арил-тетралинов # наблюдали с образованием 4-гидрокси-4-арилтетралонов # вместо ожидаемого тетралона #, о котором ранее сообщалось.[5] В результате этого открытия прямое окисление Реакция Гриньяра продукт № был опробован и оказался более эффективным путем ".
Смотрите также [6][7][8][9][10].
СНГ-/транс-Соотношение
В случае 3,4-дихлор-продукта примерно 50:50 СНГ-/транс- соотношение достигнуто, согласно справке.[4]
CAN радикал индуцировал димеризацию стирола
"Простой однореакторный синтез производных 1-амино-4-арилтетралина с помощью МОЖЕТ -индуцированный циклодимеризация различных стиролы в ацетонитрил и акрилонитрил описан ".[11][12]

Отношения структура-деятельность
Некоторые ароматические заместители обладают потенцирующим действием (например, п-Br), тогда как другие отрицают внутреннюю активность соединения.
Неправильно думать о диметиловых аналогах как о "пролекарство «к монометилированным лекарствам (см. индатралин, "31 345"), но верно, что это "латентный "форма наркотика. Это слово происходит от салсалат страница. Это была причина, по которой сертралин был получен только как монометилированный, потому что, очевидно, согласно порядку 1 ° амин неактивен, поэтому лекарство будет иметь более короткую продолжительность активности.
Энантиоочищенный транс- и СНГпроизводные аминотетралина

| Энантиоочищенные 4-ариламинотетралины IC50 (μM) | |||||||
| Стерео | Икс | Y | NE | DA | 5-HT | ||
| RS | ЧАС | ЧАС | 0.018 | 0.15 | 0.84 | ||
| SR | ЧАС | ЧАС | 0.37 | 1.40 | 14.00 | ||
| RS | Cl | ЧАС | 0.019 | 0.052 | 0.084 | ||
| SR | Cl | ЧАС | 0.46 | 1.40 | 3.50 | ||
| RS | Cl | Cl | 0.01 | 0.044 | 0.039 | ||
| SR | Cl | Cl | 0.044 | 0.27 | 0.47 | ||
| SS | Cl | Cl | 1.20 | 1.30 | 0.06 | ||
| RR | Cl | Cl | 0.30 | 0.32 | 0.46 | ||
(±) -Сертралин не совсем SERT селективный, пока он не будет решен в S,S-энантиомер.
Что касается транс- изомеры есть относительно заметное разделение активности между р,S- и S,р-энантиомеры. Это контрастирует с тем, что наблюдалось в классе гомологичных индаминов, где оба транс- энантиомеры обладали значительными TRI активность всех трех переносчиков моноаминов.
Рацемический цис- и транспроизводные аминотетралина
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Утверждается, что первичные амины полностью лишены сродства к переносчикам.
Смотрите также
- Ципрогептадин [4-(5ЧАС-дибенз- [a, d] циклогептен-5-илидин) -1-метилпиперидин]
- Дазотралин
- Десметилсертралин
- EXP-561 (1-амино-4-фенилбицикло [2.2.2] октан)
- JNJ-7925476
- Лометралин
- Нефопам
- Сертралин
Рекомендации
- ^ Ко, Б. Кеннет; Вайсман, Альберт; Уэлч, Уиллард М .; Браун, Рональд Г. (1983). «Сертралин, 1S, 4S-N-метил-4- (3,4-дихлорфенил) -1,2,3,4-тетрагидро-1-нафтиламин, новый ингибитор поглощения с селективностью в отношении серотонина». Журнал фармакологии и экспериментальной терапии. 226 (3): 686–700. PMID 6310078.
- ^ Коу, Б. Кеннет (1976). «Молекулярная геометрия ингибиторов захвата катехоламинов и серотонина в синаптосомных препаратах головного мозга крысы». Журнал фармакологии и экспериментальной терапии. 199 (3): 649–661. PMID 994022.
- ^ Сарджес, Рейнхард; Ко, Б. Кеннет; Вайсман, Альберт; Шефер, Джон П. (1974). «Блокада сердца 3Поглощение H-норэпинефрина 4-фенил-1-аминотетралинами: последствия для активной конформации имипрамин-подобных препаратов ». Журнал фармакологии и экспериментальной терапии. 191 (3): 393–402. PMID 4427286.
- ^ а б Уэлч, Уиллард М .; Краска, Аллен Р .; Сарджес, Рейнхард; Коу, Б. Кеннет (1984). «Нетрициклические антидепрессанты, полученные из СНГ- и транс-1-амино-4-арилтетралины ». Журнал медицинской химии. 27 (11): 1508–1515. Дои:10.1021 / jm00377a021. PMID 6492080.
- ^ а б Сарджес, Рейнхард (1975). «Синтез фенилзамещенных 1-аминотетралинов». Журнал органической химии. 40 (9): 1216–1224. Дои:10.1021 / jo00897a008.
- ^ а б Патент США 4045488, Sarges, Reinhard, «Соединения аминофенилтетралина», выданный 30 августа 1977 г., переуступленный Pfizer Inc.
- ^ Джонсон, Уильям С .; Петерсен, Джек В .; Шнайдер, Уильям П. (1947). «Расширение модифицированной конденсации Стоббе. Кислотно-катализируемое разложение продуктов и лакто-еновая таутомерия». Журнал Американского химического общества. 69 (1): 74–79. Дои:10.1021 / ja01193a020.
- ^ Ригель, Байрон; Берр, Джон Г. младший (1948). «Канцерогенные углеводороды. 9,11-Диметилбенз [а] антрацен и 8,9,11-триметилбенз [а] антрацен ". Журнал Американского химического общества. 70 (3): 1070–1073. Дои:10.1021 / ja01183a058. PMID 18909174.
- ^ Daub, Guido H .; Джонсон, Уильям С. (1950). «Конденсация Стоббе с гидридом натрия». Журнал Американского химического общества. 72 (1): 501–504. Дои:10.1021 / ja01157a130.
- ^ Вавзонек, Стэнли; Козиковский, Джон (1954). «2-Замещенные амино- и аминометил-4-фенил-1-тетралоны». Журнал Американского химического общества. 76 (6): 1641–1643. Дои:10.1021 / ja01635a052.
- ^ Наир, Виджай; Раджан, Рошини; Рат, Нигам П. (2002). «CAN-индуцированная циклодимеризация-стратегия захвата Риттера для синтеза 1-амино-4-арилтетралинов из стиролов в одном горшке». Органические буквы. 4 (9): 1575–1577. Дои:10.1021 / ol0257934. PMID 11975632.
- ^ «CAN-индуцированная стратегия улавливания циклодимеризации-Риттера для синтеза 1-амино-4-арилтетралинов из стиролов в одном горшке: Виджай Наир, Рошини Раджан и Нигам П. Рат». Абстрактный. Портал органической химии. Рето Мюллер. нет данных. Получено 10 ноября, 2019.
- ^ Пэн, Сяо-Цин; Си, Чжэн-Сюн; Ли, Ся; Спиллер, Криста; Ли, Цзе; Чун, Лорен; Ву, Куо-Мин; Фроймовиц, Марк; Гарднер, Элиот Л. (2010). «Является ли кокаин медленной блокадой длительного действия моноаминовой транспортной блокадой, как метадон - героином? Значение для лекарств от зависимости». Нейропсихофармакология. 35 (13): 2564–2578. Дои:10.1038 / npp.2010.133. ЧВК 2978747. PMID 20827272.
