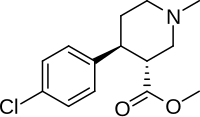
(+) - (+)-CPCA
 | |
| Клинические данные | |
|---|---|
| Код УВД |
|
| Идентификаторы | |
| |
| Количество CAS | |
| PubChem CID | |
| ChemSpider | |
| Панель управления CompTox (EPA) | |
| Химические и физические данные | |
| Формула | C14ЧАС18ClNО2 |
| Молярная масса | 267.75 г · моль−1 |
| 3D модель (JSmol ) | |
| |
| |
| | |
(+) - CPCA (нокаин, 3α-карбометокси-4β- (4-хлорфенил) -N-метилпиперидин он же CTDP 31 446[1]) это стимулятор препарат, похожий по структуре на петидин (опиоид, обладающий NDRI действия) и РТИ-31, но в нокаине отсутствует двухуглеродный мостик, как у RTI-31. тропан скелет.[2] Это соединение было впервые разработано как заменитель кокаина.
С этого времени многие заменили фенилпиперидин были обнаружены производные, гибридизирующие основную структуру нокаина со структурой других подобных молекул, таких как метилфенидат, меперидин и модафинил для создания большого семейства производных инструментов с различными профилями деятельности и потенциальными приложениями. Это важная область исследований, в которой ведется большая работа, и были разработаны десятки новых соединений, хотя ни одно из них еще не появилось на рынке.
Семейство нокаина включает разнообразный ассортимент имитаторов кокаина на основе пиперидина. Исходное соединение нокаин было разработано в попытке разработать препарат-заменитель для кокаин для лечения зависимости, и было обнаружено, что он заменяет кокаин на животных моделях, имея значительно меньший потенциал злоупотребления.
Фон
Несмотря на то что Козиковский сообщалось о соединении с хлором в 1998 г., обычное фенил Ранее об этом сообщил Plati.
Несмотря на то, что существуют новые способы производства этих соединений, предыстория связана с Arecoline химия. Например. Паксил и фемоксетин также с этой арены ЦНС химикаты. Эти антидепрессанты на основе серотонина в случае Паксил N-норметил также некоторые ацетилхолинергический согласно текстам.[нужна цитата ]
Фармакология
Как и кокаин, (-) - цис-CPCA и (+) - CPCA связываются с переносчик дофамина и подавлять дофамин усваивают, стимулируют двигательную активность грызунов и полностью заменяют кокаин в тестах на распознавание. Предварительная обработка (-) - цис-CPCA или (+) - CPCA усиливает дискриминационный стимул кокаина у крыс. Однако есть ряд отличий; двигательные стимулирующие эффекты производных пиперидина намного меньше, чем эффекты, вызванные кокаином, и предварительная обработка мышей (-) - цис-CPCA или (+) - CPCA не увеличивает вызванные кокаином судороги, а фактически снижает индуцированную кокаином локомоторную стимуляцию. (-) - Изомер цис-CPCA имеет такие же усиливающие эффекты, что и кокаин, как показали тесты самовведения с фиксированным соотношением на крысах, но (+) - CPCA имеет плоскую кривую доза-ответ, и аналогично, в то время как (-) - цис - CPCA и кокаин имели почти одинаковые точки разрыва в тесте «наказываемый ответ» (?) На самоуправление, (+) - CPCA имел более низкую точку разрыва, чем любой из других наркотиков.
| Активность обратного захвата моноаминов (нМ) | |||
| Сложный | [3H] NE | [3H] 5-HT | [3H] DA |
| Кокаин | 119 | 177 | 275 |
| (-) - cis-CPCA | 98 | 390 | 67 |
| (+) - CPCA | 90 | 5900 | 276 |
Обычно ниже эффективность (+) - CPCA в опорно-двигательного аппарата и метамфетамина испытаний дискриминации может возникнуть в результате дифференциальной селективности двух изомеров для DAT по отношению к SERT. То есть, если активация рецептора серотонина необходима для максимальной эффективности, различие сродства SERT между (-) - цис-CPCA и (+) - CPCA может играть важную роль в учете различий в наблюдаемой фармакологии. Селективные по отношению к катехоламинам препараты, такие как ТМФ (метилфенидат), обладают приличным потенциалом злоупотребления, поэтому непросто определить, почему (+) - CPCA не вызывает сильной склонности к самостоятельному введению.
Возможное объяснение может заключаться в том, что нокаин предпочтительно связывается с ↓ DAT, и в этом случае можно ожидать, что он будет вести себя несколько иначе, чем кокаин.[3] Некоторый холинергический эффект также может вызывать отвращение. Например, известно, что мускариновая активность аналогов бензтропина ограничивает их усиливающий потенциал.[4] Активность ионных каналов - еще один фактор, который можно использовать для объяснения определенных различий в фармакологии.
Возможно, что сигма рецептор активность может также объяснить некоторые различия между кокаином и этими имитаторами пиперидина (R. Matsumoto, et al. 2001,[5][6][7][8] (Пинг и Теруо, 2003 г.).[9] Сигма-рецепторы неспецифичны для кокаина, других психостимуляторов, таких как метилфенидат, метамфетамин (Э. Нгуен и др., 2005),[10] и фенциклидин также связаны с этой нервной мишенью. Повышенное понимание этого рецептора недавно привело к появлению новых сообщений о болезни Альцгеймера, основанной на ее фармакологии.[11]
Таким образом, (+) - CPCA имеет меньшую активность и эффективность, чем кокаин, в увеличении двигательной активности у грызунов. (+) - CPCA удается производить только частичные эффекты различительного стимула, подобные метамфетамину, хотя он полностью подобен кокаину у дрессированных кокаином животных. (+) - CPCA имеет более низкий усиливающий потенциал, чем кокаин, по оценке с помощью тестов на само введение с фиксированным и прогрессивным соотношением IV на крысах, с его усиливающим действием, подтвержденным на макаках-резус. Кроме того, (+) - CPCA дозозависимо противодействует локомоции, индуцированной кокаином, и усиливает различительные стимулирующие эффекты низкой дозы кокаина. (+) - CPCA, в отличие от кокаина, не усиливает судороги, вызванные кокаином. Эти результаты предполагают, что (+) - CPCA полностью имитирует определенные поведенческие действия кокаина, в то время как действует как слабый частичный агонист в других, включая его способность ослаблять вызванное кокаином усиление передвижения и служить положительным усиливающим агентом у грызунов. Таким образом, (+) - CPCA может иметь потенциальную пользу при лечении кокаиновой зависимости, а также предлагать ценную фармакологическую информацию, способствующую нашему пониманию механизма действия кокаина, поскольку он демонстрирует фундаментальные отличия от других родственных молекул DARI.
Химия
Пути синтеза
Для производства любого из фенилтропанов требуется либо источник кокаина, либо обширное и повторяющееся разделение энантиомеров из-за отсутствия энантиоселективных путей к необходимому промежуточному продукту. метилэкгонидин и большие различия в эффективности между различными структурными изомерами конечного продукта.[12]
Разработан лабораторный синтез [13] но этому мешает тот факт, что в дополнение к желаемому изомеру ангидроэкгонидина они также связаны с нежелательным энантиомером.
Модификации сложных эфиров и аминов
Был синтезирован ряд новых N- и 3α-модифицированных аналогов нокаина, SNDRI активность и поведенческие свойства мышей.[14]
Рациональный дизайн лигандов с предопределенной эффективностью и селективностью в отношении переносчиков моноаминов затруднен из-за отсутствия знаний о трехмерной структуре этих мишеней. В случаях, когда трехмерная структура сайта связывания в целевом белке не определена должным образом, как в случае транспортер моноаминов белков, можно выполнить дизайн на основе лигандов для разработки фармакофор. То есть, изучая конформационные свойства ряда фармакологически подобных соединений, можно сформировать гипотезы относительно фармакофоров.[15] Большинство сильнодействующих ингибиторов на основе тропана, в т.ч. coca, как полагают, имеют по крайней мере 3 основных взаимодействия с сайтом связывания переносчика: одно ионное или H-связывающее взаимодействие на основном азоте, одно диполь-дипольное или H-связывающее взаимодействие сложноэфирной группы и взаимодействие арильной группы с липофильным связывающим карманом. Эта модель была успешно использована для создания нового ингибитора DAT на основе пиперидина, который является экономически доступным в производстве.[16]
Хотя метаболизм (+) - CPCA in vivo также может включать N-деметилирование, метаболизм до соответствующей свободной кислоты с образованием соединения, неактивного по отношению ко всем переносчикам моноаминов, вероятно, будет преобладающим путем. in vivo. Было высказано предположение, что метаболизма через действие эстеразы можно избежать, заменив сложноэфирную группу биоизостерической группой, которая более устойчива к метаболической деградации. В предыдущих исследованиях было обнаружено, что оксадиазол, хотя и подобен кокаину по активности, проявляет значительно более длительную продолжительность действия из-за более медленной скорости метаболизма. В целом, по сравнению с соответствующими N-метильными соединениями, норпиперидины проявляли повышенную активность в отношении SERT / NET и лишь умеренные изменения в DAT.
| Ki (нМ) | |||
| р | NE | DA | 5HT |
| CO2Мне | 252 → 7.9 | 233 → 279 | 8490 → 434 |
| CH2OH | 198 → 69 | 497 → 836 | 1550 → 239 |
| Оксадиазол | 256 → 34 | 187 → 189 | 5960 → 373 |
Интересная разница между кокаином и сложным эфиром 1а, алкоголь 2а, и norester 1b заключается в том, что последние два соединения значительно дольше действуют, чем кокаин, в тестах на двигательную активность у мышей. Хотя от таких соединений, как алкоголь, ожидается продолжительное действие 2а и оксадиазол 3а в которых отсутствует эфирная группа 3α и поэтому их сложнее метаболизировать, для норэстера этого не ожидается 1b, поскольку сложноэфирная группа 3α должна гидролизоваться так же легко, как и сложноэфирная группа кокаина и 1а. Другой результат N-деметилирования - начальное угнетающее действие 1b с последующей задержкой двигательной стимуляции, которая может быть связана с взаимодействием с рецепторами ГАМК или mGlu5.[17]
Дизайн 3β-замещенного нокаинового лиганда
В более раннем исследовании было обнаружено, что 3α-амидо и объемные лиганды 3α-оксадиазоил нокаина, которые обладают большей стабильностью по сравнению с функциональной группой сложного эфира и, следовательно, более привлекательны в качестве потенциальных методов лечения, неактивны. Этот результат привел к гипотезе о том, что сайт связывания DAT и NET в непосредственной близости от 3α-положения пиперидинового кольца является компактным и не может вместить объемные, стерически закрытые заместители, такие как 3-замещенный 1,2,4-оксадиазолил группы. Было высказано предположение, что введение метиленового спейсера придаст улучшенное сродство связывания переносчика моноаминов полученным молекулам.[18]

| р | [3H] DA | [3H] 5-HT | [3H] NE |
| CO2Мне | 233 | 8490 | 252 |
| CONMe2 | 2140 | 18900 | 569 |
| CH2OAc | 599 | 901 | 235 |
| CH2ОСН2CH = CH2 | 60 | 231 | 20 |
| CH2CO2Et | 79 | 191 | 101 |
| CH2CONMe2 | 16 | 1994 | 46 |
| Гетероцикл | 44 | 32 | 52 |
| CH2CH2CO2Мне | 68 | 255 | 31 |
| транс-CH = CHCO2Мне | 53 | 501 | 272 |
| Prп | 20 | 228 | 6.5 |
| (CH2)3ОЙ | 16 | 2810 | 564 |
Одна из возможных причин того, что соединения C2 – C3 более активны, чем соединения C1, заключается в том, что полярная группа, присутствующая в более гибком 3α-придатке лигандов C2 – C3, способна избегать неблагоприятных взаимодействий с участком связывания в непосредственной близости. к пиперидиновому кольцу. По той же причине придаток в серии C2 – C3 может более точно, но не точно имитировать способ связывания более активного SS лиганды на основе и, возможно, даже переход на соединения на основе тропана.
Чтобы лучше понять разницу между сериями C1 и C2 – C3, соединения были минимизированы по энергии и гибко наложены на WIN-35,428. Полученное наложение показывает, что только лиганды C2 – C3 способны принимать конформацию, в которой полярная группа 3α-заместителя занимает положение, проксимальное к положению 2β-полярной группы в WIN35428.
Нокаин: отросток серы

Фармакофор
Общепризнанный фармакофор модель для кокаина и фенилтропаны включает два электростатических взаимодействия основного азота и сложноэфирной группы заместителя C-2 и одно гидрофобное взаимодействие арильной группы C-3.[19] Эта модель оспаривалась из-за открытия, что в некоторых соединениях ни основной N, ни сложноэфирная группа не были необходимы для высокой аффинности связывания и ингибирования MAR. Вместо этого было предложено существование гидрофобного кармана вблизи углерода C-2. Carroll et al., Однако, предоставили дополнительные доказательства электростатического взаимодействия в C-2β-положении в более позднем исследовании.
Другие модели, предложенные для сайта связывания DAT, включают линейный карман связывания для 3β-замещенных аналогов фенилтропана,[20] и запрещенная коническая область на расстоянии примерно 5,5-10 Å от 3α-замещенного пиперидинового кольца.[21] Примечательно, что высокая эффективность DAT димерных эфиров и амидов на основе пиперидина позволяет предположить, что гибкий линкер, объединяющий две единицы пиперидина, способен регулировать свою ориентацию и избегать неблагоприятных взаимодействий с сайтом связывания.[22] Все эти данные свидетельствуют о том, что сайт связывания DAT намного сложнее, чем предлагаемые модели фармакофора.
В попытке раскрыть детали сайта связывания DAT был проведен ряд исследований 3D-QSAR. Несколько исследований QSAR / CoMFA, сфокусированных на фенилтропанах, пришли к выводу, что повышенный отрицательный электростатический потенциал в областях вокруг 3β-заместителя тропанового кольца и пара-положения фенильного кольца способствует высокой эффективности ингибирования MAT. Райт и др. изучили роль 3β-заместителя тропанов в связывании с DAT и блокировании повторного захвата DA. Их модель CoMFA показала, что сайт связывания 3β-заместителя является бочкообразный и гидрофобные взаимодействия вносят доминирующий вклад в связывание,[20] что согласуется с исследованиями 3α-замещенных аналогов тропана, опубликованными Newman et al. Ньюман и соавторы также изучили N-замещенные тропаны и пришли к выводу, что стерическое взаимодействие N-заместителя с DAT является основным фактором сродства связывания.

Смотрите также
- Список аналогов кокаина
- 1-метил-3-пропил-4- (п-хлорфенил) пиперидин
- N, O-диметил-4- (2-нафтил) пиперидин-3-карбоксилат[25]
- JZ-IV-10 и другие гибриды модафинила[26][27]
- 4-фторпетидин и другие петидин (меперидин) аналоги.[3]
- NET избирательно.[28][29]
- Компьютер.[19][30]
Рекомендации
- ^ Mobele, Bingidimi I .; Кинахан, Тарин; Ulysse, Luckner G .; Ганье, Стивен В .; Айронсайд, Майкл Д .; Knox, Graham S .; Мохаммади, Фарахназ (2006). «Разработка процесса в направлении экспериментального синтеза аналога кокаина на основе пиперидина и сильного ингибитора обратного захвата допамина и норэпинефрина CTDP 31,446». Исследования и разработки в области органических процессов. 10 (5): 914–920. Дои:10.1021 / op060114g. ISSN 1083-6160.
- ^ Козиковски А.П., Аралди Г.Л., Боя Дж., Мейл В.М., Джонсон К.М., Флиппен-Андерсон Дж. Л. и др. (Май 1998 г.). «Химия и фармакология аналогов кокаина на основе пиперидина. Идентификация сильнодействующих ингибиторов DAT, лишенных тропанового скелета». Журнал медицинской химии. 41 (11): 1962–9. Дои:10,1021 / jm980028 +. PMID 9599245.
- ^ а б Ломенцо С.А., Роден Дж. Б., Изенвассер С., Уэйд Д., Копайтик Т., Кац Дж. Л., Труделл М. Л. (март 2005 г.). «Синтез и биологическая оценка аналогов меперидина на переносчиках моноаминов». Журнал медицинской химии. 48 (5): 1336–43. Дои:10.1021 / jm0401614. PMID 15743177.
- ^ Цзоу М.Ф., Цао Дж., Копайтич Т., Десаи Р.И., Кац Дж.Л., Ньюман А.Х. (октябрь 2006 г.). «Исследования взаимосвязи структура-активность новой серии (S) -2-бета-замещенных аналогов 3альфа- [бис (4-фтор- или 4-хлорфенил) метокси] тропана для исследования in vivo». Журнал медицинской химии. 49 (21): 6391–9. Дои:10.1021 / jm060762q. PMID 17034144.
- ^ Мацумото Р.Р., Хьюетт К.Л., Поув Б., Боуэн В.Д., Мужья С.М., Цао Дж.Дж., Ньюман А.Х. (декабрь 2001 г.). «Аналоги римказола ослабляют судорожные эффекты кокаина: корреляция со связыванием с сигма-рецепторами, а не с переносчиками дофамина». Нейрофармакология. 41 (7): 878–86. Дои:10.1016 / S0028-3908 (01) 00116-2. PMID 11684152. S2CID 44328858.
- ^ Мацумото Р.Р., Маккракен К.А., Фридман М.Дж., Поув Б., Де Коста Б.Р., Боуэн В.Д. (май 2001 г.). «Конформационно ограниченные аналоги BD1008 и антисмысловой олигодезоксинуклеотид, нацеленные на рецепторы сигма1, вызывают у мышей антикокаиновый эффект». Европейский журнал фармакологии. 419 (2–3): 163–74. Дои:10.1016 / S0014-2999 (01) 00968-2. PMID 11426838.
- ^ Мацумото Р.Р., Маккракен К.А., Поув Б., Чжан И., Боуэн В.Д. (июнь 2002 г.). «Участие сигма-рецепторов в поведенческих эффектах кокаина: данные новых лигандов и антисмысловых олигодезоксинуклеотидов». Нейрофармакология. 42 (8): 1043–55. Дои:10.1016 / S0028-3908 (02) 00056-4. PMID 12128006. S2CID 34846910.
- ^ Мацумото Р.Р., Лю Й., Лернер М., Ховард Е.В., Брэкетт Д.Д. (май 2003 г.). «Сигма-рецепторы: потенциальная цель разработки лекарств против кокаиновых агентов». Европейский журнал фармакологии. 469 (1–3): 1–12. Дои:10.1016 / S0014-2999 (03) 01723-0. PMID 12782179.
- ^ Су Т.П., Хаяси Т. (октябрь 2003 г.). «Понимание молекулярного механизма рецепторов сигма-1: к гипотезе о том, что рецепторы сигма-1 являются внутриклеточными усилителями для передачи сигнала». Современная лекарственная химия. 10 (20): 2073–80. Дои:10.2174/0929867033456783. PMID 12871086.
- ^ Нгуен Э.К., Маккракен К.А., Лю Й., Поув Б., Мацумото Р.Р. (октябрь 2005 г.). «Вовлечение сигма (сигма) рецепторов в острые действия метамфетамина: связывание рецепторов и поведенческие исследования». Нейрофармакология. 49 (5): 638–45. Дои:10.1016 / j.neuropharm.2005.04.016. PMID 15939443. S2CID 41068558.
- ^ Ван Дж., Мак А.Л., Кооп А., Мацумото Р.Р. (ноябрь 2007 г.). «Новые агонисты сигма (сигма) рецепторов вызывают у мышей эффекты, подобные антидепрессантам». Европейская нейропсихофармакология. 17 (11): 708–16. Дои:10.1016 / j.euroneuro.2007.02.007. ЧВК 4041597. PMID 17376658.
- ^ Кларк Р.Л., Даум С.Дж., Гамбино А.Дж., Ацето М.Д., Перл Дж., Левитт М. и др. (Ноябрь 1973 г.). «Соединения, влияющие на центральную нервную систему. 4. 3 Бета-фенилтропан-2-сложные эфиры и аналоги». Журнал медицинской химии. 16 (11): 1260–7. Дои:10.1021 / jm00269a600. PMID 4747968.
- ^ Патент США 5736556
- ^ Петухов П.А., Чжан Дж., Козиковский А.П., Ван Ч.З., Йе Ю.П., Джонсон К.М., Телла С.Р. (июль 2002 г.). «SAR-исследования аналогов кокаина на основе пиперидина. 4. Эффект N-модификации и замены сложного эфира». Журнал медицинской химии. 45 (15): 3161–70. Дои:10.1021 / jm0200153. PMID 12109901.
- ^ Froimowitz M, Gu Y, Dakin LA, Nagafuji PM, Kelley CJ, Parrish D, et al. (Январь 2007 г.). «Алкильные аналоги метилфенидата замедленного действия, длительного действия с повышенной селективностью в отношении переносчика дофамина». Журнал медицинской химии. 50 (2): 219–32. Дои:10.1021 / jm0608614. PMID 17228864.
- ^ Wang S, Sakamuri S, Enyedy IJ, Kozikowski AP, Deschaux O, Bandyopadhyay BC, et al. (Февраль 2000 г.). «Открытие нового ингибитора переносчика дофамина, 4-гидрокси-1-метил-4- (4-метилфенил) -3-пиперидил-4-метилфенилкетона, в качестве потенциального антагониста кокаина посредством поиска фармакофоров в базе данных 3D. Молекулярное моделирование, структура- отношения активности и поведенческие фармакологические исследования ". Журнал медицинской химии. 43 (3): 351–60. Дои:10.1021 / jm990516x. PMID 10669562.
- ^ Кьямулера С., Эппинг-Джордан депутат, Зокки А., Маркон С., Коттини С., Таккони С. и др. (Сентябрь 2001 г.). «Усиливающие и стимулирующие двигательные эффекты эффекты кокаина отсутствуют у мышей с нулевым мутантом mGluR5». Природа Неврология. 4 (9): 873–4. Дои:10.1038 / nn0901-873. PMID 11528416. S2CID 1314227.
- ^ Петухов П.А., Чжан Дж., Ван Ч.З., Е Ю.П., Джонсон К.М., Козиковский А.П. (июнь 2004 г.). «Синтез, молекулярное моделирование и биологические исследования новых аналогов кокаина на основе пиперидина: свидетельства неблагоприятных взаимодействий, проксимальных к 3-альфа-положению пиперидинового кольца». Журнал медицинской химии. 47 (12): 3009–18. Дои:10.1021 / jm0303296. PMID 15163183.
- ^ а б Юань Х., Козиковский А.П., Петухов П.А. (декабрь 2004 г.). «Исследование CoMFA пиперидиновых аналогов кокаина на переносчике дофамина: изучение способа связывания 3 альфа-заместителя пиперидинового кольца с использованием гибкого выравнивания на основе фармакофора». Журнал медицинской химии. 47 (25): 6137–43. Дои:10.1021 / jm049544s. PMID 15566285.
- ^ а б Лиске С.Ф., Ян Б., Эльдефрави М.Э., МакКерелл А.Д., Райт Дж. (Март 1998 г.). «(-) - 3 бета-замещенные метиловые эфиры экгонина в качестве ингибиторов связывания кокаина и поглощения дофамина». Журнал медицинской химии. 41 (6): 864–76. Дои:10.1021 / jm970025h. PMID 9526561.
- ^ Петухов П.А., Чжан М., Джонсон К.Дж., Телла С.Р., Козиковский А.П. (август 2001 г.). «Исследование Sar аналогов кокаина на основе пиперидина. Часть 3: оксадиазолы». Письма по биоорганической и медицинской химии. 11 (16): 2079–83. Дои:10.1016 / S0960-894X (01) 00379-1. PMID 11514143.
- ^ Tamiz AP, Bandyopadhyay BC, Zhang J, Flippen-Anderson JL, Zhang M, Wang CZ и др. (Май 2001 г.). «Фармакологический и поведенческий анализ эффектов некоторых ингибиторов обратного захвата моноаминов на основе бивалентных лигандов». Журнал медицинской химии. 44 (10): 1615–22. Дои:10.1021 / jm000552s. PMID 11334571.
- ^ Амат М., Бош Дж., Идальго Дж., Канто М., Перес М., Ллор Н. и др. (Май 2000 г.). «Синтез энантиочистых транс-3,4-дизамещенных пиперидинов. Энантиодивергентный синтез (+) - и (-) - пароксетина». Журнал органической химии. 65 (10): 3074–84. Дои:10.1021 / jo991816p. PMID 10814199.
- ^ Johnson TA, Jang DO, Slafer BW, Curtis MD, Beak P (октябрь 2002 г.). «Асимметричные образования углерод-углеродных связей при сопряженных присоединениях литиированных N-Boc аллильных и бензильных аминов к нитроалкенам: энантиоселективный синтез замещенных пиперидинов, пирролидинов и пиримидинонов». Журнал Американского химического общества. 124 (39): 11689–98. Дои:10.1021 / ja0271375. PMID 12296735.
- ^ Тамиз А.П., Чжан Дж., Флиппен-Андерсон Дж. Л., Чжан М., Джонсон К. М., Дешо О. и др. (Март 2000 г.). «Дальнейшие SAR-исследования аналогов кокаина на основе пиперидина. 2. Сильные ингибиторы обратного захвата дофамина и серотонина». Журнал медицинской химии. 43 (6): 1215–22. Дои:10.1021 / jm9905561. PMID 10737754.
- ^ Чжоу Дж., Хе Р., Джонсон К.М., Йе Й., Козиковски А.П. (ноябрь 2004 г.). «Гибридные лиганды нокаина / модафинила на основе пиперидина как сильнодействующие ингибиторы переносчиков моноаминов: эффективное открытие лекарств путем рациональной гибридизации свинца». Журнал медицинской химии. 47 (24): 5821–4. Дои:10.1021 / jm040117o. ЧВК 1395211. PMID 15537337.
- ^ He R, Kurome T, Giberson KM, Johnson KM, Kozikowski AP (декабрь 2005 г.). «Дальнейшие исследования взаимосвязи структура-активность ингибиторов переносчиков моноаминов на основе пиперидина: влияние стереохимии пиперидинового кольца на эффективность. Идентификация лигандов, селективных в отношении переносчиков норадреналина, и ингибиторов переносчиков широкого спектра действия». Журнал медицинской химии. 48 (25): 7970–9. Дои:10.1021 / jm050694s. PMID 16335921.
- ^ Musachio JL, Hong J, Ichise M, Seneca N, Brown AK, Liow JS и др. (Июнь 2006 г.). «Разработка новых агентов для визуализации мозга на основе гибридных ингибиторов моноаминового переносчика нокаина и модафинила». Письма по биоорганической и медицинской химии. 16 (12): 3101–4. Дои:10.1016 / j.bmcl.2006.03.066. PMID 16621532.
- ^ Чжоу Дж (декабрь 2004 г.). «Ингибиторы транспортера норэпинефрина и их терапевтический потенциал». Наркотики будущего. 29 (12): 1235–1244. Дои:10.1358 / DOF.2004.029.12.855246. ЧВК 1518795. PMID 16871320.
- ^ Юань Х., Петухов П.А. (декабрь 2006 г.). «Улучшенный 3D-QSAR CoMFA блокаторов переносчиков дофамина с множественными конформациями с использованием генетического алгоритма». Письма по биоорганической и медицинской химии. 16 (24): 6267–72. Дои:10.1016 / j.bmcl.2006.09.037. PMID 17027270.
