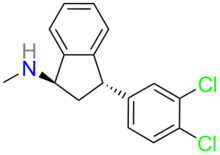
Индатралин - Indatraline
 | |
| Клинические данные | |
|---|---|
| Маршруты администрация | Устный |
| Код УВД |
|
| Легальное положение | |
| Легальное положение |
|
| Идентификаторы | |
| |
| Количество CAS | |
| PubChem CID | |
| ChemSpider | |
| UNII | |
| ЧЭМБЛ | |
| Панель управления CompTox (EPA) | |
| Химические и физические данные | |
| Формула | C16ЧАС15Cl2N |
| Молярная масса | 292.20 г · моль−1 |
| 3D модель (JSmol ) | |
| |
| |
| (проверить) | |
Индатралин (Лу 19-005) не-селективный транспортер моноаминов ингибитор, который, как было показано, блокирует обратный захват из дофамин, норэпинефрин, и серотонин с эффектами, аналогичными эффектам кокаин. Однако было показано, что эффекты имеют более медленное начало и более длительную продолжительность, чем кокаин, что позволяет предположить, что это соединение, наряду с аналогичными соединениями, может использоваться для лечения кокаиновой зависимости.[1] По-видимому, Лу 19-005 можно использовать для блокирования действия метамфетамин и МДМА.[2]
Сравните индатралин с таметралин поскольку они прямо гомологичны. Однако есть некоторые отличия. Суперпозиция должен позволить увидеть, что существует, по крайней мере, связь между фармакофором индатралина и различными фенилтропанами. Совсем недавно была проделана и дополнительная работа.[3]
Транс
Если индатралин является N-алкилированным, можно замедлить начало действия, если выбор алкильной группы достаточно громоздок, так что это не произойдет до N-деметилирование происходит, что молекулы становятся действительно активными.[3] N-метилиндатралин имеет гораздо более длительный срок действия, чем индатралин, потому что нориндатралин неактивен, тогда как деметилирование N-метилиндатралина не прекращает действия исходного соединения. Большинство программ по борьбе с наркозависимостью придерживаются мнения, что DRI с «медленным началом и длительным действием» менее подвержен злоупотреблениям (см. Volkow и другие). Очевидно, что N-метиловые продукты не просто неактивны. пролекарства хотя.
Измерение передвижение был записан в 10-минутные бины. В то время как для кокаина двигательная активность (LMA) проявлялась уже через 10 минут, по крайней мере 20 минут потребовалось до NMe2 аналоги даже начали увеличивать двигательную активность. На самом деле очень высокие дозы означают меньше передвижения. Причина этого была увеличена стереотипия. Из таблицы очевидно, что более крупные N-группы приводят к увеличению селективности DAT по сравнению с SERT и NET. Хотя нет необходимости вдаваться в подробности, авторы действительно хотели SNDRI.[нужна цитата ]
Рацемический
N-Деметиловые аналоги, расположенные справа от стрелки, предполагая, что они метаболизируются именно так in vivo.
[125Я] RTI-55 использовали в качестве связывающего лиганда на всех 3 транспортерах.
| Рацемический (транс) 3 ', 4'-дихлориндамины. Kя и IC50 (нМ) | ||||||||
| Стерео | R1 | R2 | DAT | DA | SERT | 5-HT | СЕТЬ | NE |
| Rac | меня | меня | 19 → 27 | 200 → 23 | 0.33 → 5.0 | 65 → 4.8 | 95 → 22 | 34 → 15 |
| Rac | Et | меня | 39 → 8.1 | 270 → 61 | 16 → 2.0 | 24 → 13 | 250 → 48 | 150 → 28 |
| Rac | Pr | меня | 250 → 220 | 340 → 53 | 91 → 130 | 190 → 480 | 400 → 55 | 640 → 130 |
| Rac | Prя | меня | 180 → 32 | 190 → 51 | 44 → 93 | 1500 → 240 | 260 → 110 | 420 → 75 |
| Rac | Бут | меня | 890 → 130 | 2700 → 370 | 4700 → 740 | > 10 мкм → 3100 | 440 → 150 | 1000 → 310 |
| Rac | Млрд | меня | 120 → 80 | 550 → 380 | 180 →> 10 мкм | 3700 →> 10 мкм | 2800 → 460 | 1600 → 2600 |
Отдельные энантиомеры
| Транс 3 ', 4'-Дихлориндамины. Kя и IC50 (нМ) | ||||||||
| Стерео | R1 | R2 | DAT | DA | SERT | 5-HT | СЕТЬ | NE |
| (±)-транс | меня | меня | 19 | 200 | 0.33 | 65 | 95 | 34 |
| (+)-транс | меня | меня | 8.7 | 120 | 0.06 | 6.3 | 52 | 21 |
| (–)-транс | меня | меня | 38 | 650 | 3.6 | 130 | 130 | 130 |
В эвдизм между двумя энантиомерами N-метилиндатралина не так высок, как сообщалось в случае таметралин. Токсичность изомера R, S меньше, чем для изомера S, R.
СНГ
| СНГ 3 ', 4'-Дихлориндамины. Kя и IC50 (нМ) | ||||||||
| R1 | R2 | DAT | DA | SERT | 5-HT | СЕТЬ | NE | |
| меня | меня | 63 → 290 | 550 → 500 | 2.4 → 38 | 5.5 → 4.0 | 150 → 600 | 86 → 130 | |
| Et | меня | 660 → 140 | 530 → 1000 | 13 → 4.7 | 72 → 19 | 2400 → ? | 4400 → 170 | |
| Pr | меня | 1200 → 280 | 1000 → 620 | 200 → 500 | 810 → 1300 | 2000 → 540 | 540 → 630 | |
| Prя | меня | 680 → 450 | 960 → 1400 | 73 → 130 | 1800 → 300 | 650 → 3500 | 1800 → 1500 | |
| Бут | меня | 2800 → 650 | > 10 мкМ → 1500 | > 10 мкм → 1700 | ? →> 10 мкм | 2200 → 1100 | > 10 мкм → 1800 | |
| Млрд | меня | > 10 мкм → 1100 | ? → 5300 | 300 → 2100 | 700 →> 10 мкм | > 10 мкм → 4800 | > 10 мкМ →> 10 мкМ | |
Химия
Сообщается о двух основных маршрутах. Первый показанный маршрут - это оригинальный маршрут, о котором сообщили Bøgesø и его коллеги.[4]

другой был адаптирован для увеличения:[5]

Хотя недавно был опубликован новый метод получения индатралина,[6] очевидно, что есть несколько способов получения этого соединения.
См. Например: 6525206
К сожалению для 1-инданон промежуточных звеньев метод не доступен для прямого уменьшения я добываю или оксим. Сообщается, что образуются неправильные диастереомеры (цис), тогда как транс-изомеры являются теми, которые необходимы. Это мешает синтезу, поскольку необходимо добавить дополнительный шаг. Сначала кетоны восстанавливаются до в основном цис-спиртов, которые затем превращаются в соответствующие мезилаты, сохраняя стереохимию. Затем они могут реагировать, например, с N-метилбензиламин, оказывающий Инверсия Уолдена (SN2). Окончательное удаление бензила дает продукт, хотя он рацемический.
Смотрите также
Рекомендации
- ^ Негус СС, Брандт М.Р., Мелло Н.К. (октябрь 1999 г.). «Эффекты длительного действия ингибитора обратного захвата моноаминов индатралина на самовведение кокаина у макак-резусов». Журнал фармакологии и экспериментальной терапии. 291 (1): 60–9. PMID 10490887.
- ^ Rothman RB, Partilla JS, Baumann MH, Dersch CM, Carroll FI, Rice KC (март 2000 г.). «Нейрохимическая нейтрализация метамфетамина с помощью высокоаффинных неселективных ингибиторов биогенных переносчиков амина: фармакологическая стратегия лечения злоупотребления стимуляторами». Синапс. 35 (3): 222–7. Дои:10.1002 / (SICI) 1098-2396 (20000301) 35: 3 <222 :: AID-SYN7> 3.0.CO; 2-K. PMID 10657029.
- ^ а б Гарднер Э.Л., Лю X, Паредес В., Джордано А., Спектор Дж., Лепор М. и др. (Октябрь 2006 г.). «Медленно действующий, длительный ингибитор обратного захвата инданамина моноамина в качестве потенциальной поддерживающей фармакотерапии при злоупотреблении психостимуляторами: эффекты в лабораторных моделях крыс, связанные с зависимостью». Нейрофармакология. 51 (5): 993–1003. Дои:10.1016 / j.neuropharm.2006.06.009. PMID 16901516.
- ^ Bøgesø KP, Christensen AV, Hyttel J, Liljefors T (декабрь 1985 г.). «3-фенил-1-инданамины. Потенциальная антидепрессивная активность и сильное ингибирование захвата дофамина, норадреналина и серотонина». Журнал медицинской химии. 28 (12): 1817–28. Дои:10.1021 / jm00150a012. PMID 2999402.
- ^ Froimowitz M, Wu KM, Moussa A, Haidar RM, Jurayj J, George C, Gardner EL (декабрь 2000 г.). «Блокаторы обратного захвата 3- (3 ', 4'-дихлорфенил) -1-инданамина длительного действия с медленным действием в качестве потенциальных лекарств для лечения злоупотребления кокаином». Журнал медицинской химии. 43 (26): 4981–92. Дои:10.1021 / jm000201d. PMID 11150168.
- ^ Сильва Л.Ф., Сикейра Ф.А., Педрозо Е.С., Виейра Ф.Ю., Доригетто А.С. (апрель 2007 г.). «Стимулируемое йодом (III) сокращение цикла 1,2-дигидронафталинов: диастереоселективный полный синтез (+/-) - индатралина». Органические буквы. 9 (8): 1433–6. Дои:10.1021 / ol070027o. PMID 17371034.
